Для опыта удобно воспользоваться реакцией
FeCl3 + 3KSCN ↔ Fe(SCN)3 + 3KCl
Из веществ этой системы только роданид железа (III) Fe(SCN)3 окрашен в красный цвет. Поэтому всякое изменение его концентрации можно легко заметить по изменению интенсивности окраски раствора, что позволяет сделать вывод о направлении смещения равновесия системы при изменении концентрации реагирующих веществ.
Смешать в пробирке равные объемы разбавленных растворов хлорида железа (III) и роданида калия. Полученный раствор разлить поровну в 4 пробирки. Оставить одну пробирку для сравнения, а в трех других изменить концентрации реагирующих веществ. Для этого добавить в первую пробирку несколько капель концентрированного раствора роданида калия, во вторую – несколько капель концентрированного раствора хлорида железа (III), в третью – кристаллического хлорида калия. Сравнить окраску в трех пробирках с контрольной.
Требования к результатам опыта:
1. Сделать вывод о смещении химического равновесия в каждой пробирке.
2. Сформулировать правило смещения равновесия при изменении концентрации реагирующих веществ.
3. Написать выражение константы равновесия для данной реакции.
Опыт 2. Влияние температуры на химическое равновесие
Прибор, состоящий из двух шаров, заполнен смесью оксида азота (IV) и его димером. Чистый оксид азота (IV) существует при температуре выше
140 оС. Ниже этой температуры NO2 частично полимеризуется по уравнению:
|
|
|
2NO2 ↔ N2O4, ΔH0 = -23 кДж
NO2 – газ бурого цвета, N2O4 – бесцветен. Изменение температуры позволяет судить о смещении равновесия в системе по изменению интенсивности окраски газов.
Один шар прибора опустить в стакан с холодной, а второй – в стакан с горячей водой. Наблюдать изменение интенсивности окраски газов в шарах.
Требования к результатам опыта:
1. Сделать вывод о направлении смещения равновесия в данной реакции при нагревании и охлаждении.
2. Сформулировать правило смещения равновесия при изменении температуры.
3. Написать выражение константы равновесия для данной реакции.
Примеры решения задач
Пример 6.1. При некоторой температуре в системе
N2 (г) + 3Н2 (г) 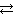 2NH3 (г) равновесные концентрации составляли (моль/л):
2NH3 (г) равновесные концентрации составляли (моль/л):
[N2] = 1,5; [H2] = 1,7; [NH3] = 2,6. Вычислить константу равновесия этой реакции и исходные концентрации азота и водорода.
Решение.Константа равновесия данной реакции выражается уравнением  . Подставляя данные задачи, получаем:
. Подставляя данные задачи, получаем: 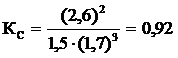 .
.
Исходные концентрации азота и водорода находим на основе уравнения реакции. Согласно уравнению реакции на образование 2 моль NH3 расходуется 1 моль N.2. По условию задачи образовалось 2,6 моль NH3, на что израсходовалось 1,3 моль N2. Учитывая равновесную концентрацию азота, находим его исходную концентрацию:  = 1,5 + 1,3 = 2,8 моль/л.
= 1,5 + 1,3 = 2,8 моль/л.
|
|
|
По уравнению реакции на образование 2 моль NH3 необходимо 3 моль H2, а для получения 2,6 моль NH3 требуется 3×2,6 / 2 = 3,9 моль H2. Исходная концентрация водорода  = 1,7 + 3,9 = 5,6 моль/л. Таким образом, КС = 0,92; исходные концентрации
= 1,7 + 3,9 = 5,6 моль/л. Таким образом, КС = 0,92; исходные концентрации 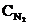 = 2,8 моль/л,
= 2,8 моль/л, 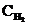 = 5,6 моль/л.
= 5,6 моль/л.
Пример 6.2. Реакция протекает по уравнению А + В 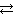 D + F. Определить равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В, соответственно, равны 2 и 1,2 моль/л, а константа равновесия реакции КС = 1.
D + F. Определить равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В, соответственно, равны 2 и 1,2 моль/л, а константа равновесия реакции КС = 1.
Решение. Так как все вещества в данной реакции реагируют в одинаковых соотношениях, обозначим изменение концентрации всех реагирующих веществ через x. К моменту установления равновесия образовалось х моль D и х моль F и соответственно [D] = x; [F] = x. По уравнению реакции на столько же уменьшились концентрации А и В, т. е. [A] = 2 – x; [B] = 1,2 – x. Подставим равновесные концентрации в выражение константы равновесия:
КС= 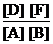 ; 1=
; 1= 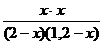 ; х = 0,75.
; х = 0,75.
Отсюда равновесные концентрации: [D] = 0,75 моль/л; [F] = 0,75 моль/л; [A] = 2 – 0,75 = 1,25 моль/л; [B] = 1,2 – 0,75 = 0,45 моль/л.
Пример 6.3. Реакция протекает по уравнению 2SO2 + O2 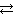 2SO3. В каком направлении сместится химическое равновесие, если объем системы уменьшить в 3 раза?
2SO3. В каком направлении сместится химическое равновесие, если объем системы уменьшить в 3 раза?
|
|
|
Решение. До изменения объема скорости прямой и обратной реакций выражались уравнениями:
vпр = 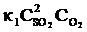 ; vобр =
; vобр = 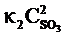 .
.
При уменьшении объема в 3 раза концентрация каждого из реагирующих веществ увеличится в 3 раза. После увеличения концентрации скорость прямой реакции стала: vпр = k1×(3 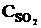 )2×(3
)2×(3 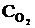 ) = k1× 9
) = k1× 9 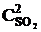 × 3
× 3 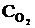 = 27k1
= 27k1 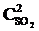
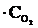 ,
,
т. е. возросла в 27 раз; а скорость обратной – vобр = k2× (3 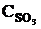 )2 = k2× 9
)2 = k2× 9 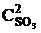 = 9k2
= 9k2 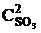 , т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).
, т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).
Пример 6.4. В какую сторону сместится химическое равновесие реакции А + В 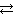 D, если повысить температуру на 30 оС? Температурные коэффициенты скорости прямой и обратной реакции равны соответственно 2 и 3.
D, если повысить температуру на 30 оС? Температурные коэффициенты скорости прямой и обратной реакции равны соответственно 2 и 3.
Решение. При повышении температуры на 30° скорость прямой реакции возрастет в 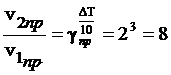 раз, а скорость обратной в
раз, а скорость обратной в 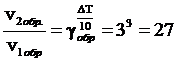 раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево).
раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево).
Пример 6.5. Как изменятся скорости прямой и обратной реакции, если в системе 2NO (г) + О2 (г) 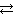 2NO2 (г) уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Если да, то в какую сторону?
2NO2 (г) уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Если да, то в какую сторону?
|
|
|
Решение. До уменьшения давления выражения для скорости прямой и обратной реакции имели вид vпр = k1 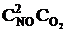 , vобр = k2
, vобр = k2 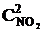 .
.
При уменьшении давления в 2 раза концентрации каждого из реагирующих веществ уменьшаются в 2 раза, так как общий объем системы увеличивается в 2 раза. Тогда
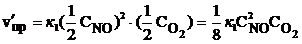 ;
; 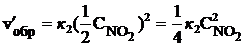 .
.
В результате уменьшения давления скорость прямой реакции уменьшилась в 8 раз, а скорость обратной – в 4 раза. Таким образом, скорость обратной реакции будет в 2 раза больше, чем прямой, и смещение равновесия произойдет в сторону обратной реакции, т. е. в сторону разложения NO2.
Пример 6.6. В каком направлении сместится равновесие реакции
COCl2 ↔ СО + Cl2, ∆H0х.р. = +112,5 кДж а) при повышении давления;
б) с понижением температуры; в) при уменьшении концентрации хлора.
Решение. а) При повышении давления равновесие смещается в сторону реакции, идущей с уменьшением числа молекул газа, при понижении давления – в сторону реакции, идущей с увеличением числа молекул газа. В левой части приведенной реакции 1 молекула (COCl2), а в правой – 2 (1 СО и 1 Cl2), поэтому при повышении давления равновесие смещается в сторону обратной реакции;
б) При понижении температуры равновесие смещается в сторону экзотермической реакции, при повышении температуры – в сторону эндотермической. В нашем примере прямая реакция эндотермическая (∆H0х.р. > 0), а обратная – экзотермическая, следовательно, при понижении температуры равновесие сместится в сторону обратной реакции;
в) При увеличении концентрации исходных веществ и уменьшении концентрации продуктов реакции равновесие смещается в сторону продуктов реакции. При уменьшении концентрации хлора (продукта реакции) равновесие сместится в сторону прямой реакции, т.е. в сторону образования продуктов реакции.
Задачи
№ 6.1. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции 2NO2 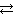 2NO + O2 установилось при следующих концентрациях (моль/л): [NO2] = 0,4; [NO] = 1; [O2] = 0,5. Вычислить константу равновесия для этой температуры и исходную концентрацию диоксида азота. (Ответ: 3,125; 1,4 моль/л).
2NO + O2 установилось при следующих концентрациях (моль/л): [NO2] = 0,4; [NO] = 1; [O2] = 0,5. Вычислить константу равновесия для этой температуры и исходную концентрацию диоксида азота. (Ответ: 3,125; 1,4 моль/л).
№ 6.2. Реакция протекает по уравнению АВ 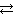 А + В. При некоторой температуре из 1 моль АВ, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,6 моль АВ. Определить константу равновесия. (Ответ: 0,045).
А + В. При некоторой температуре из 1 моль АВ, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,6 моль АВ. Определить константу равновесия. (Ответ: 0,045).
№ 6.3.Константа равновесия реакции N2O4 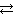 2NO2 равна 0,16 при 375 К. Равновесная концентрация NO2 равна 0,09 моль/л. Вычислить равновесную концентрацию N2O4. (Ответ: 0,051 моль/л).
2NO2 равна 0,16 при 375 К. Равновесная концентрация NO2 равна 0,09 моль/л. Вычислить равновесную концентрацию N2O4. (Ответ: 0,051 моль/л).
№ 6.4. Рассчитать равновесную концентрацию О3 и константу равновесия в реакции 3О2 (г) 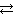 2О3 (г), если начальная масса О2 равна 24 г, а равновесная концентрация О2 равна 0,6 моль/л. (Ответ: 0,1 моль/л; 0,046).
2О3 (г), если начальная масса О2 равна 24 г, а равновесная концентрация О2 равна 0,6 моль/л. (Ответ: 0,1 моль/л; 0,046).
№ 6.5. Используя справочные данные табл. 1 приложения, рассчитать ΔН0х.р. реакции, протекающей по уравнению 2NO2 (г) 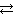 2NO (г) + O2 (г) и определить, в какую сторону сместится равновесие при охлаждении системы.
2NO (г) + O2 (г) и определить, в какую сторону сместится равновесие при охлаждении системы.
№ 6.6. Рассчитать равновесные концентрации газообразных веществ в гетерогенной системе FeO (к) + CO (г) 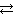 Fe (к) + CO2 (г), если начальная концентрация СО составляла 2 моль/л, константа равновесия КС = 0,6.
Fe (к) + CO2 (г), если начальная концентрация СО составляла 2 моль/л, константа равновесия КС = 0,6.
(Ответ: 1,25 моль/л; 0,75 моль/л.).
№ 6.7. При состоянии равновесия системы N2 + 3H2 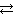 2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитать, как изменятся скорости прямой и обратной реакции, если концентрации всех участвующих в реакции веществ увеличить в 4 раза. В каком направлении сместится равновесие? (Ответ: 256; 16).
2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитать, как изменятся скорости прямой и обратной реакции, если концентрации всех участвующих в реакции веществ увеличить в 4 раза. В каком направлении сместится равновесие? (Ответ: 256; 16).
№ 6.8. Вычислить константу равновесия для гомогенной системы:
CO (г) + H2O (г)  СO2 (г) + H2 (г), если равновесные концентрации реагирующих веществ (моль/л): [CO] = 0,004; [H2O] = 0,064; [CO2] = 0,016, [H2] = 0,016. Чему равны исходные концентрации воды и СО?
СO2 (г) + H2 (г), если равновесные концентрации реагирующих веществ (моль/л): [CO] = 0,004; [H2O] = 0,064; [CO2] = 0,016, [H2] = 0,016. Чему равны исходные концентрации воды и СО?
(Ответ: 1; 0,08 моль/л; 0,02 моль/л).
№ 6.9. В начальный момент протекания реакции
NiO (к) + Н2 (г) 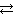 Ni (к) + H2O (г) концентрации были равны (моль/л):
Ni (к) + H2O (г) концентрации были равны (моль/л): 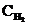 = 0,5;
= 0,5; 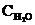 = 1,7. Рассчитать равновесные концентрации газообразных веществ, если КС = 5,66. (Ответ: 0,33 моль/л; 1,87 моль/л).
= 1,7. Рассчитать равновесные концентрации газообразных веществ, если КС = 5,66. (Ответ: 0,33 моль/л; 1,87 моль/л).
№ 6.10. В реакторе при некоторой температуре протекает реакция
СО2 + Н2 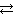 СО + Н2О. Определить константу равновесия, если в начальный момент
СО + Н2О. Определить константу равновесия, если в начальный момент 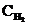 = 2,15 моль/л,
= 2,15 моль/л, 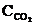 = 1,25 моль/л, а к моменту равновесия прореагировало 60 % начального количества СО2. (Ответ: 0,8).
= 1,25 моль/л, а к моменту равновесия прореагировало 60 % начального количества СО2. (Ответ: 0,8).
№ 6.11. Определить, в какую сторону произойдет смещение равновесия реакции CO2 (г) + 4Н2 (г) 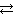 СН4 (г) + 2Н2О (г), ∆Н0х.р = -165 кДж
СН4 (г) + 2Н2О (г), ∆Н0х.р = -165 кДж
при следующих воздействиях: а) увеличении давления; б) повышении концентрации СО2; в) понижении температуры.
№ 6.12. В гомогенной системе установилось равновесие
2H2S + 3O2 ↔ 2SO2 + 2H2O. Константа равновесия КС = 3∙105. Исходные вещества или продукты реакции будут преобладать в равновесной смеси веществ?
Вычислить равновесную концентрацию диоксида серы, если равновесные концентрации веществ, участвующих в реакции, равны (моль/л):
[H2S] = 0,02; [O2] = 0,30; [H2O] = 0,40. (Ответ: 4,5 моль/л).
№ 6.13. Рассчитать КС реакции PCl5 (г)  PCl3 (г) + Cl2 (г) при 500 К, если к моменту равновесия разложилось 54 % PCl5, а исходная концентрация PCl5 была равна 1 моль/л. (Ответ: 0,634).
PCl3 (г) + Cl2 (г) при 500 К, если к моменту равновесия разложилось 54 % PCl5, а исходная концентрация PCl5 была равна 1 моль/л. (Ответ: 0,634).
№ 6.14. После смешивания газов А и В в системе А (г) + В (г)  С (г) +D (г) устанавливается равновесие при следующих концентрациях: [B] = 0,5 моль/л; [C] = 0,2 моль/л. Константа равновесия реакции равна 4×10-2. Найти исходные концентрации вещества А и В. (Ответ: 2,2 моль/л; 0,7 моль/л).
С (г) +D (г) устанавливается равновесие при следующих концентрациях: [B] = 0,5 моль/л; [C] = 0,2 моль/л. Константа равновесия реакции равна 4×10-2. Найти исходные концентрации вещества А и В. (Ответ: 2,2 моль/л; 0,7 моль/л).
№ 6.15. Система С (графит) + СО2 (г)  2СО (г), DН0х.р = 172,5 кДж
2СО (г), DН0х.р = 172,5 кДж
находится в состоянии равновесия. Как повлияет на равновесие системы:
а) повышение температуры; б) понижение давления; в) понижение концентрации СО2?
№ 6.16. При некоторой температуре равновесные концентрации в систеие
2SO2 + O2 = 2SO3 составляли (моль/л): [SO2] = 0,04; [O2] = 0,06; [SO3] = 0,02. Определить константу равновесия и исходные концентрации SO2 и O2.
(Ответ: 4,17; 0,06 моль/л; 0,07 моль/л).
№ 6.17.Реакция протекает по уравнению NO + Cl2 ↔ NOCl2, DН < 0
Какие изменения а) температуры; б) давления; в) концентраций участвующих в реакции веществ способствуют увеличению выхода продукта реакции?
№ 6.18. Константа равновесия реакции FeO (к) + СО (г)  Fe (к) + СО2 (г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л):
Fe (к) + СО2 (г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л): 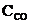 = 0,08;
= 0,08; 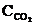 = 0,02. (Ответ: 0,67 моль/л; 0,33 моль/л).
= 0,02. (Ответ: 0,67 моль/л; 0,33 моль/л).
№ 6.19. Система N2 (г) + 3Н2 (г)  2NH3 (г); DН0х.р= -92,4 кДж находится в состоянии равновесия. Определить, в каком направлении сместится равновесие: а) с ростом температуры; б) при повышении давления; в) при понижении концентрации NH3.
2NH3 (г); DН0х.р= -92,4 кДж находится в состоянии равновесия. Определить, в каком направлении сместится равновесие: а) с ростом температуры; б) при повышении давления; в) при понижении концентрации NH3.
№ 6.20. Найти константу равновесия реакции N2O4  2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия разложилось 50 % N2O4. (Ответ: 0,16).
2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия разложилось 50 % N2O4. (Ответ: 0,16).
Лабораторная работа 7
Дата добавления: 2018-06-27; просмотров: 386; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
