Определение теплоты реакции нейтрализации
Цель работы: изучить основные понятия термохимии (экзо- и эндотермические реакции, тепловой эффект, энтальпия, энтальпия образования вещества) , закон Гесса и следствие из закона Гесса.
Задание: провести реакцию нейтрализации и определить повышение температуры. На основании полученных данных рассчитать изменение энтальпии и тепловой эффект реакции. Выполнить требования к результатам работы, оформить отчет, решить задачу.
Теоретическое введение
Химические реакции сопровождаются выделением или поглощением энергии (чаще всего теплоты). Реакции, протекающие с выделением теплоты, называются экзотермическими, а с поглощением теплоты – эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектом реакции. Тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы ΔН. При экзотермической реакции энтальпия системы уменьшается (ΔН < 0), а при эндотермической – энтальпия системы увеличивается (ΔН > 0).
Если исходные вещества и продукты реакции находятся в стандартном состоянии, то в этом случае энтальпию реакции называют стандартной и обозначают ΔН0.
Определение тепловых эффектов может быть осуществлено опытным путем с помощью калориметра или путем вычислений. В основе термохимических расчетов лежит закон Гесса:тепловой эффект химической реакции (т. е. изменение энтальпии ΔН) зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
|
|
|
Часто в термохимических расчетах применяют следствиеиз закона Гесса:энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энтальпия реакции nА + mВ → рС + qD рассчитывается по формуле
ΔН 0х..р == ( р Δ f Н 0 С + q Δ f Н 0 , D) − ( n Δ f Н 0 А + mΔ f Н0B),
где Δ f Н0 – стандартная энтальпия образования вещества.
Стандартной энтальпией образования веществаназывается стандартная энтальпия реакции образования 1 моль данного вещества из простых веществ.
Выполнение работы
Любая реакция нейтрализации сильной кислоты щелочью сводится к процессу
Н+ + ОН‾ → Н2О
Для определения теплового эффекта реакции можно воспользоваться упрощенным калориметром, состоящим из трех стаканов – внешнего и двух внутренних.
В сухой внутренний стакан калориметра с помощью мерного цилиндра налить 25 мл 1 н раствора щелочи. В другой сухой стакан налить 25 мл 1 н раствора серной кислоты. Опустить в раствор щелочи термометр. Записать температуру и, не вынимая термометр из стакана, быстро влить кислоту в щелочь. Осторожно помешивая раствор термометром, отметить и записать максимальную температуру. Эту температуру считать конечной.
|
|
|
Требования к результатам работы:
Полученные данные занести в таблицу.
Данные опыта и результаты расчетов Таблица 3.1
| Температура Т, К | Изменение энтальпии ∆Н, кДж | ∆Н0нейтр.практ, кДж/моль | ∆Н0нейтр. теор, кДж/моль | Относит. ошибка опыта Е, % | |
| началь-ная | конечная | ||||
Вычислить (все вычисления пояснить словами):
1. Изменение энтальпии реакции ∆Н по формуле
ΔH = −V ∙ ρ ∙ c ∙ ΔТ,
где V – общий объем раствора, мл; ρ– плотность раствора г/мл; с – теплоемкость раствора, Дж/г ∙ К; ΔТ – разность между конечной и начальной температурами. Принять плотность раствора после нейтрализации равной 1 г/мл, а
теплоемкость его − равной теплоемкости воды, т. е. 4,18 Дж/г ∙ К.
2. Тепловой эффект реакции нейтрализации ∆Н0нейтр.практ в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л (1000 мл) раствора, а для реакции было взято 25 мл, то
|
|
|

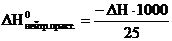
3. Теоретическое значение изменение энтальпии реакции нейтрализации 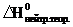 для уравнения Н+ + ОН‾ → Н2О. Энтальпии образования Δ f Н0 Н+, ОH‾ и Н2О соответственно равны 0, -230,2 и -285,8 кДж/моль.
для уравнения Н+ + ОН‾ → Н2О. Энтальпии образования Δ f Н0 Н+, ОH‾ и Н2О соответственно равны 0, -230,2 и -285,8 кДж/моль.
4. Относительную ошибку опыта (Е) 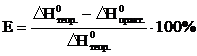
 Примеры решения задач
Примеры решения задач
При решении задач этого раздела следует пользоваться табл. I приложения Б.
Пример 3.1.Вычислить тепловой эффект и написать термохимическое уравнение реакции горения ацетилена, в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 10 л ацетилена (н.у.)?
Решение. Реакция горения ацетилена протекает по уравнению
С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (г).
Пользуясь следствием из закона Гесса и справочными данными из табл.I, вычисляем тепловой эффект реакции:
DH0х.р. = (2 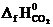 +
+ 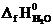 ) − (
) − ( 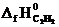 + 5½
+ 5½ 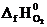 )
)
DH0х.р. = [2(-393,5) + (-241,8)] − (226,8 + 5½ ∙ 0) = -1255,6 кДж.
Термохимическими называются уравнения химических реакций, в которых указано изменение энтальпии. Изменение энтальпии (тепловой эффект) записывают в правой части уравнения после запятой.
Термохимическое уравнение реакции горения ацетилена имеет вид:
|
|
|
С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (г), DH0х.р. = –1255,6 кДж.
Тепловой эффект обычно относят к одному молю вещества. Следовательно, при сжигании 1 моль С2Н2 выделяется 1255,6 кДж. Однако по условию задачи сжигается 10 л ацетилена, что составляет 10 / 22,4 = 0,446 моль С2Н2, где 22,4 л/моль – мольный объем любого газа при нормальных условиях. Таким образом, при сгорании 0,446 моль (10 л) С2Н2 выделится 0,446×(1255,6) = 560 кДж теплоты.
Пример 3.2. Реакция идет по уравнению Fe2O3 + 2Al = 2Fe + Al2O3.
При восстановлении 48 г Fe2O3 выделяется 256,1 кДж теплоты. Вычислить тепловой эффект реакции и стандартную энтальпию образования Fe2O3.
Решение.Число молей Fe2O3, содержащихся в 48 г Fe2O3, составляет 48 / 160 = 0,3 моль, где 160 г/моль – молярная масса Fe2O3. Так как тепловой эффект относят к 1 моль вещества, то тепловой эффект данной реакции равен –256,1 / 0,3 = –853,7 кДж. Запишем термохимическое уравнение этой реакции:
Fe2O3 + 2Al = 2Fe + Al2O3, DH0х.р.= –853,8 кДж/
Формула для расчета теплового эффекта данной реакции имеет вид
DH0х.р.= (2 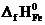 +
+ 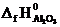 ) – (
) – ( 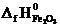 + 2
+ 2 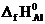 ), отсюда находим
), отсюда находим 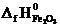
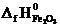 = 2
= 2 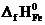 +
+ 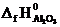 – 2
– 2 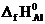 –
–  .
.
После подстановки справочных данных из табл.I получаем:
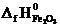 = 2 × 0 – 1676 – 2 × 0 + 853,8 = –822,2 кДж/моль.
= 2 × 0 – 1676 – 2 × 0 + 853,8 = –822,2 кДж/моль.
Таким образом, тепловой эффект реакции равен –853,8 кДж, а 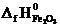 составляет –822,2 кДж/моль.
составляет –822,2 кДж/моль.
Пример 3.3.Исходя из термохимических уравнений
Н2 (г) + О2 (г) = Н2О2 (ж), 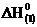 = –187 кДж; (1)
= –187 кДж; (1)
Н2О2 (ж) + Н2 (г) = 2Н2О (г), 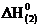 = –297 кДж; (2)
= –297 кДж; (2)
Н2О (г) = Н2О (ж), 
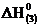 = – 44 кДж, (3)
= – 44 кДж, (3)
рассчитать значение стандартной энтальпии реакции образования Н2О (ж).
Решение.Запишем уравнение реакции, тепловой эффект которой необходимо определить: Н2 (г) + ½О2 (г) = Н2О (ж), 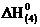 –? (4)
–? (4)
В уравнения (1), (2), (3) входят Н2О2 (ж) и Н2О (г), которые не входят в уравнение (4). Чтобы исключить их из уравнений (1), (2), (3), умножим уравнение (3) на 2 и сложим все три уравнения:
Н2 (г) + О2 (г) + Н2О2 (ж)+ Н2 (г) + 2Н2О (г) = Н2О2 (ж) + 2Н2О (г) + 2Н2О (ж). (5)
После преобразования уравнения (5) и деления его на 2 получаем искомое уравнение (4). Аналогичные действия проделаем с тепловыми эффектами:
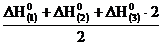 .=
.= 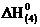
В результате получаем 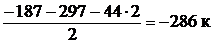 Дж;
Дж;
т.е. энтальпия образования Н2О (ж). 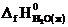 = –286 кДж/моль.
= –286 кДж/моль.
Пример 3.4.В каком направлении будет протекать реакция при стандартных условиях СН4 (г) + СО2 (г) ↔ 2СО (г) + 2Н2 (г)
Решение.Направление протекания химической реакции определяет энергия Гиббса (∆G). Изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. Формула для расчета изменение энергии Гиббса изучаемой реакции имеет вид:
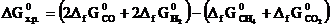
Значения 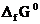 берем из табл. 1 приложения и получаем:
берем из табл. 1 приложения и получаем:
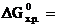 [2 ∙ (-137,1) + 2 ∙ 0] − [(-50,8) + (-394,4)] = +171 кДж.
[2 ∙ (-137,1) + 2 ∙ 0] − [(-50,8) + (-394,4)] = +171 кДж.
При р=const, T=const реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса. Если ∆G < 0, то реакциясамопроизвольно протекает в прямом направлении. Если ∆G > 0, то самопроизвольное протекание процесса в прямом направлении невозможно. Если ∆G = 0, то реакция может протекать как в прямом направлении, так и в обратном, и система находится в состоянии равновесия.
Так как ∆G0х.р = +171 кДж, т.е. > 0, то самопроизвольное протекание данной реакции в прямом направлении в стандартных условиях невозможно.
Пример 3.5. Определить изменение энтропии в стандартных условиях для реакции С (графит) + 2Н2 (г) = СН4 (г)
Решение.Изменение энтропии системы в результате протекания химической реакции (∆S) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов:
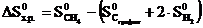
Подставляем в формулу справочные данные из табл.I и получаем:
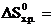 186,2 − (5,7 + 2 ∙ 130,6) = -80,7 Дж/К.
186,2 − (5,7 + 2 ∙ 130,6) = -80,7 Дж/К.
Пример 3.6. По значениям стандартных энтальпий образования и стандартных энтропий веществ, участвующих в реакции, вычислить изменение энергии Гиббса реакции, протекающей по уравнению
СО (г) + Н2О (ж) = СО2 (г) + Н2 (г).
Решение.Изменение энергии Гиббса в химической реакции при температуре Т можно вычислить по уравнению
∆G0х.р. = ∆Н0х.р – Т∆S0х.р.
Тепловой эффект реакции ∆Н0х.р и изменение энтропии определяем по следствию из закона Гесса:
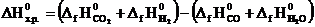 ;
;
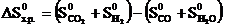
Используя справочные данные табл. 1, получаем:
∆Н0х.р. = [(-393,5) + 0] − [(-110,5) + (-285,8)] = +2,8 кДж;
∆S0х.р = (213,7 + 130,6) − (197,5 + 70,1) = +76,7 Дж/К
Изменение энергии Гиббса в химической реакции:
∆G0х.р. = ∆Н0х.р. – Т∆S0х.р.; Т = 298 К;
∆G0х.р = 2,8 − 298 ∙ 76,7 ∙ 10-3 = -20,05 кДж
Пример 3.7.Определить температуру, при которой установится равновесие в системе СаСО3 (к) 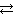 СаО (к) + СО2 (г)
СаО (к) + СО2 (г)
Решение. При химическом взаимодействии одновременно изменяется энтальпия, характеризующая стремление системы к порядку, и энтропия, характеризующая стремление системы к беспорядку. Если тенденции к порядку и беспорядку в системе одинаковы, то ∆H0х.р. = Т∆S0х.р., что является условием равновесного состояния системы. Отсюда можно определить температуру, при которой устанавливается равновесие химической реакции для стандартного состояния реагентов: 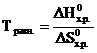 .
.
Сначала вычисляем ∆Н0х.р. и ∆S0х.р.по формулам:
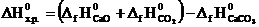
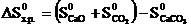
Используя справочные данные табл.I получаем:
DH0х.р. = [– 635,5 + (–393,5)] – (–1207,1) = 178,1 кДж;
DS0х.р. = (39,7 + 213,7) – 92,9 = 160,5 Дж/К или 0,1605 кДж/К.
Отсюда, температура, при которой устанавливается равновесие:
Травн = 178,1 / 0,1605 = 1109,5 К.
Пример 3.8.ВычислитьDH0х.р, ∆S0х.р. и DG0T реакции, протекающей по уравнению: Fe2O3 (к) + 3C (к) = 2Fe (к) + 3CO (г).
Возможна ли реакция восстановления Fe2O3углеродом при температуре 298 и 1000 К?
Решение.Вычисляем DH0х.р. и DS0х.р.:
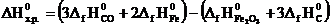
DH0х.р.=[3(–110,5) + 2·0] – [–822,2 + 3·0] = –331,5 + 822,2 = +490,7 кДж;
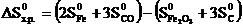
DS0х. р. = (2·27,2 +3·197,5) – (89,9 + 3·5,7) = 539,9 Дж/К или 0,540 кДж/К.
Дата добавления: 2018-06-27; просмотров: 1039; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
