ДИФФУЗНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ РАСТВОРЕНИЯ
В основе технологического процесса лежит растворение твердых веществ.
Растворение – диффузионно-кинетический процесс, протекающий при соприкосновении растворяемого вещества с растворителем. В фармацевтической практике растворы получают из твердых, порошкообразных, жидких и газообразных веществ. Как правило, получение растворов из жидких веществ протекает без особых трудностей как их простое смешивание. Растворение же твердых веществ, особенно медленно-и труднорастворимых является сложным и трудоемким процессом. При растворении можно выделить условно следующие стадии:
1. контактирование поверхности твердого тела с растворителем, сопровождающееся смачиванием, адсорбцией и проникновением растворителя в микропоры частиц твердого тела;
2. взаимодействие молекул растворителя со слоями вещества на поверхности раздела фаз, сопровождающееся сольватацией молекул или ионов и их отрывом;
3. переход сольватированных молекул или ионов в жидкую фазу;
4. выравнивание концентраций во всех слоях растворителя.
Длительность 1 и 4 стадии зависит преимущественно от скорости диффузионных процессов, 2 и 3 часто протекают мгновенно или достаточно быстро и имеют кинетический характер (механизм химических реакций). Из этого следует, что в основном скорость растворения зависит от диффузионных процессов.
Впервые диффузионный механизм растворения описан А. Н. Шукаревым в 1896 г. в виде уравнения, на основании которого скорость процесса зависит от разности концентраций и поверхности раздела фаз. Современная теория исходит из представления о том, что могут протекать как диффузионные, так и межфазные химические процессы. Исходным положением диффузионно-кинетической теории следует считать наличие пограничного диффузионного слоя и его влияния на изменение скорости
|
|
|
процесса, кинетика которого описывается следующим уравнением:
 , где
, где
 – количество вещества, растворяющегося в единицу времени (скорость растворения), кг/с;
– количество вещества, растворяющегося в единицу времени (скорость растворения), кг/с;
D – коэффициент диффузии;
υ – коэффициент скорости межфазного процесса;
σ– эффективная толщина пограничного диффузионного слоя, м;
S – площадь поверхности твердой фазы, м2;
С0 – концентрация насыщенного раствора, кг/м3;
Сt – концентрация раствора в данный момент времени, кг/м3;
n – порядок реакции растворения, который в воде почти для всех лекарственных веществ равен единице (кинетическая область растворения).
Константа скорости растворения К при постоянном объеме жидкой фазы определяется выражением
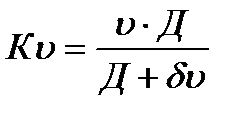
В зависимости от соотношения диффузионных и кинетических (межфазных) механизмов возможны три основных типа растворения: диффузионный – υ → Д/σ; Кυ → Д/σ, кинетический υ « Д/σ; Кυ → υ и диффузионно-кинетический, когда значения коэффициента скоростей межфазного и диффузионных процессов являются сопоставимыми.
|
|
|
В производстве растворение желательно проводить, ускоряя диффузию за счет перемешивания жидкой фазы. Однако для медленно- и труднорастворимых веществ межфазный процесс имеет место даже при интенсивном перемешивании.
Смачивание твердого тела зависит от полярности растворителя и поверхности, свойства которой могут изменяться за счет адсорбции воздуха, влаги или примесей, ее пористости и шероховатости, наличия дефектов кристаллической решетки и микротрещин. Для увеличения смачиваемости целесообразно измельчение проводить в среде растворителя, предупреждающего адсорбцию, например воздуха, или добавляя поверхностно-активные вещества. Молекулы или ионы твердой фазы и растворителя взаимодействуют, образуя соответствующие сольваты или их ассоциаты. Близкие по свойствам и структуре растворимые системы, например соединения гомологического ряда или изомеры, между собой почти не взаимодействуют, их свойства сохраняются, изменяется только концентрация веществ в растворе и иногда – агрегатное состояние. Однако чаще между растворителем и поверхностными молекулами твердых тел образуются водородные связи, происходит междипольное взаимодействие.
|
|
|
Это приводит к образованию сольватов, ассоциированных комплексов с разной степенью устойчивости и диссоциации комплексов и молекул на ионы. В таких растворах вещество и растворитель находятся в измененном состоянии по сравнению с исходным.
Согласно молекулярно-кинетической теории гидратации при растворении веществ, дающих частицы с достаточно высокой плотностью заряда (ионы Li+, Ca++, Mg++ и др.), молекулы растворителя, находящиеся вокруг этих частиц, притягиваются, их подвижность уменьшается, реже происходит обмен с другими молекулами. Это явление получило название положительной гидратации. Некоторые ионы, такие как К+, Na+ , Rb+, Cs+, Вr- J-, Cl-, как бы отталкивают молекулы растворителя, что вызывает увеличение обмена между ними по сравнению с чистым растворителем, возрастает их неупорядоченность, происходит отрицательная гидратация, для которой характерен только определенный диапазон температур. При достижении предельных температур отрицательная гидратация переходит в положительную. Так, для ионов Na+, Cs+, CI-, J- эти температуры соответственно равны +11°С, 89°С, 27°С, 75°С. Это объясняется тем, что с повышением вышеуказанной температуры преобладает тепловое движение молекул растворителя. Многообразие взаимодействий так велико, что до настоящего времени нет единой теории растворов.
|
|
|
Современные представления о процессе растворения позволяют уже сейчас на научной основе трактовать закономерности в изменении биологической доступности и терапевтической активности лекарственных веществ в растворах в зависимости от диэлектрической проницаемости, наличия постоянных и индуцированных дипольных моментов, поляризуемости ионов и молекул растворенного вещества. В технологии растворов становится понятной роль выбора среды, добавок электролита, высокомолекулярных соединений, ПАВ и т. д.
При растворении разрушаются связи между молекулами или ионами в растворяемом веществе и растворителе, что связано с затратой энергии. Одновременно с этим начинается процесс комплексообразования, т. е. возникают новые связи между молекулами и ионами, образуются сольваты. Процесс сопровождается выделением энергии. Общее энергетическое изменение в системе может быть положительным или отрицательным. Так, при растворении этанола, многих щелочей, кислот и других веществ в воде выделяется тепло, поэтому дополнительное нагревание приводит к уменьшению растворимости и, наоборот, при поглощении тепла, нагревание увеличивает растворимость. Иногда растворение сопровождается изменением суммарного объема (явлением контракции). Это происходит при смешивании метанола, этанола, глицерина и других спиртов с водой.
Очевидно, что данным процессом можно управлять, варьируя различными технологическими факторами. Так, для увеличения скорости растворения можно изменять температурный режим, увеличивать разность концентраций, уменьшать вязкость и толщину пограничного диффузионного слоя путем изменения гидродинамических условий, измельчать исходное вещество, увеличивая поверхность контакта с растворителем. Для реализации этих возможностей технологический процесс ведут в реакторах, имеющих рубашку для обогрева паром или охлаждения системы рассолом, и перемешивающее устройство. Перемешивание позволяет перемещать слои жидкости в реакторе, увеличивая разность концентраций и заменяя молекулярную диффузию в жидкой среде на конвективный и турбулентный массоперенос. Интенсивное перемешивание уменьшает толщину диффузионного пограничного слоя.
В условиях гетерогенного массообмена жидкость обтекает частицы твердой фазы разными способами. Прямое обтекание происходит, когда жидкость перемещается между неподвижными частицами твердой фазы. Его скорость зависит от скорости движения жидкости. Гравитационное обтекание возникает при падении частиц твердой фазы в движущейся жидкости. Естественная циркуляция осуществляется за счет разности плотностей жидкости и твердой фазы. Инерционное обтекание происходит под действием сил инерции в тех случаях, когда поток или струя жидкости меняет свое направление, а твердые частицы, движущиеся в этой жидкости с определенной скоростью под действием инерции, не могут изменить направление движения. Скорость обтекания частиц в этом способе будет самой большой, а толщина диффузионного пограничного слоя у частиц твердой фазы – минимальной.
В реальных условиях массообмен происходит с участием нескольких способов обтекания, наиболее благоприятные условия создаются при гравитационном и инерционном. Гидродинамический режим процесса связан не только со способом обтекания, но и со скоростью потока жидкости. При ламинарном движении скорость конвективной диффузии увеличивается только в направлении движения потока и зависит от молекулярной вязкости. При турбулентном (вихревом) потоке массоперенос может осуществляться даже в поперечном направлении, и скорость массопереноса не зависит от молекулярной вязкости. Интенсивный массоперенос способствует быстрому завершению растворения.
ЗАНЯТИЕ №7
Дата добавления: 2018-06-01; просмотров: 3471; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
