Скорость реакции определяется изменением концентрации прореагировавшего или образующегося вещества в единицу времени.
υ =  =
= 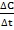 ,
,
где ∆С = С1 - С2
∆t = t2 - t1
Факторы, влияющие на скорость реакции:
Природа реагирующих веществ.
Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в неорганических и органических веществах.
Zn + CH3COOH (слабая кислота) υ1
˄
Zn + HCl (сильная кислота) υ2
Степень измельченности веществ (для веществ в твердом состоянии).
S(тв.) + O2 (газ) = SO2 - гетерогенная реакция
Сера сгорает быстро лишь при предварительном измельчении.
Концентрация (С) реагирующих веществ (для веществ в растворенном состоянии и газов).
Горение веществ в чистом кислороде происходит интенсивнее, чем в воздухе, где концентрация кислорода почти в пять раз меньше.
Температура.
Правило Вант-Гоффа:
При повышении температуры на каждые 10°С скорость большинства реакций увеличивается в 2 - 4 раза.

υ1 - скорость химической реакции при начальной температуре
υ2 - скорость химической реакции при конечной температуре
γ (гамма) - температурный коэффициент, показывает, во сколько раз увеличивается скорость химической реакции при повышении температуры на каждые 10⁰.
Присутствие некоторых веществ (катализаторы и ингибиторы).
| t |
|
|
|
| MnO2 |
MnO2 - катализатор
В присутствии ингибиторов (формалин, уротропин) H2SO4 становится инертной по отношению к металлам, что используют при перевозке серной кислоты в стальных цистернах.
Обратимые и необратимые химические реакции. Химическое равновесие. Условия смещения химического равновесия. Принцип Ле-Шателье.
Химическое равновесие - это состояние обратимого химического процесса, при котором скорости прямой и обратной реакции равны между собой.
| υпр |
| υобр |
υпр = υобр наступает химическое равновесие
С наступлением химического равновесия реакция не прекращается, и это состояние может тянуться достаточно долго, если поддерживать в системе постоянные условия: концентрации реагирующих веществ и продуктов реакции, температуру, давление (если среди реагирующих веществ или продуктов реакции присутствуют газы).
Химическое равновесие называютдинамическим.
Во многих случаях хим. равновесие является фактором нежелательным, поэтому необходимо сместить его в сторону наиболее необходимого продукта реакции, например, в сторону аммиака.
Факторы, влияющие на смещение химического равновесия.
|
|
|
Температура.
СаСО3↔ СаО + СО2 - Q
Если реакция эндотермична, то при повышении температуры химическое равновесие смещается в сторону конечных продуктов реакции.
2SO2 + O2 ↔ 2SO3 + Q
Если реакция экзотермична, то при повышении температуры химическое равновесие смещается в сторону исходных веществ.
Давление.
| N2 + 3H2 ↔ 2NH3 1 об 3об 2 об 4 об Если реакция идет с уменьшением объема, то при повышении давления химическое равновесие смещается в сторону меньшего объема. | N2 + O2 ↔ 2NO 1об 1об 2об 2 об Если реакция идет без изменения объема, то изменение давления не повлияет на смещение химического равновесия. |
Концентрация.
N2 + 3H2 ↔ 2NH3
υ = k С N2 С3H2
Крав = C2NH3 / С N2 С3H2
Увеличение концентрации одного из реагирующих веществ либо уменьшение концентрации одного из продуктов реакции будет способствовать ускорению прямого процесса, а увеличение концентрации продукта реакции приведет к ускорению обратного процесса.
Например, в реакции N2 + 3H2 ↔ 2NH3 ускорит синтез выведение аммиака из сферы реакции (уменьшение концентрации конечного продукта) и увеличение концентраций водорода и азота (увеличение концентраций реагирующих веществ).
|
|
|
Смещение химического равновесия под действием внешних условий описывает принцип Ле Шателье:
При изменении внешних условий протекания химической реакции (температуры, давления, концентрации веществ), при которых данная система находится в состоянии химического равновесия, равновесие сместится в сторону той реакции, которая препятствует этому изменению.
Катализатор не влияет на смещение химического равновесия, он в равной степени ускоряет как прямую, так и обратную реакции.
Дата добавления: 2018-06-01; просмотров: 454; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
