Технологические характеристики твёрдых катализаторов
Твёрдые катализаторы – высокопористые вещества с развитой внутренней поверхностью, характеризуются определенной пористой и кристаллической структурой, активностью, селективностью и т.д.
Твёрдые промышленные катализаторы состоят из:
1) носитель – твёрдое тугоплавкое вещество (Al2О3);
2) активатор – активное вещество, которое непосредственно влияет на активность катализатора, т.е. увеличивает скорость гетерогенных каталитических реакций
Характеристики:
1) Активность – мера ускоряющего воздействия по отношению к данной реакции. Количественным критерием активности катализатора может служить константа скорости, измеренная для различных катализаторов в сопоставимых условиях, т.е. в стандартных. Такой подход применим, если для всех сравниваемых катализаторов остаётся одинаковым порядок реакции.
Иногда сравнивают катализаторы по скорости реакций или по степени превращения реагентов. По количеству реагентов, вступающих во взаимодействие в единицу времени на единицу поверхности катализатора. Если каталитическая реакция имеет такой же порядок, что и некаталитическая (т.е. константа скорости каталитической реакции и константа скорости некаталитической реакции имеют одинаковые единицы измерения), то активность катализаторов можно определить как отношение констант скоростей
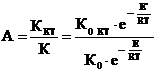
где К0 КТ; ККТ – соответственно константы скорости каталитической реакции и некаталитической реакции
|
|
|
Е`; Е – соответственно энергия активации каталитической реакции и некаталитической реакции
2) Температура зажигания – это минимальная температура, при которой технологический процесс начинает идти с достаточной скоростью для практических целей. С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания, что позволяет уменьшить энергетические затраты на предварительный нагрев реакционной смеси
3) Селективность – способность катализатора избирательно ускорять целевую реакцию при наличии нескольких побочных реакций. Если одновременно протекают несколько параллельных реакций, то можно подобрать различные селективные катализаторы для каждой из этих реакций
1) Al2О3
С2Н5ОН ® С2Н4 + Н2О
2) Присутствие меди или серебра
С2Н5ОН ® СН3СН = О + Н2
3) Al2О3 + ZnO
2С2Н5ОН ® С4Н6 + 2Н2О + Н2
Селективность также зависит от условий проведения процесса (температура, давление) и от области протекания гетерогенного каталитического процесса (кинетическая, внешнедиффузионная или внутридиффузионная области)
4) Время контактирования
 - истинное время контактирования
- истинное время контактирования
|
|
|
где vсв – свободный объём катализатора;
Vсм – объём реакционной смеси
Эффективное время контактирования
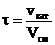
где vкат – объём катализатора
Наиболее целесообразно использовать в расчётах истинное время контактирования, но в практике чаще пользуются эффективным временем контактирования
5) Стойкость к отравлению
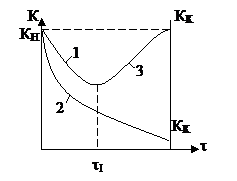 |
1 – обратимое отравление
2 – необратимое отравление
3 – восстановление активности
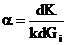 - коэффициент отравления
- коэффициент отравления
где Gi – масса яда, поступающего с реагентами на единицу
массы катализатора за время ti
Изменение константы скорости каталитической
реакции при отравлении катализатора от КН до КК
|
|
|
Основные методы приготовления катализаторов:
1. Осаждение гидроксидов или карбонатов из растворов их солей совместно с носителем или без носителя с последующим формированием и прокаливанием контактной массы
2. Смешение и совместное прессование порошков с получением смешанных катализаторов или катализаторов с активаторами и носителями, а также с вяжущими веществами
3. Сплавление нескольких веществ (металлов и их оксидов) с последующим восстановлением металлов из оксидов водородом
4. Пропитка хлористого носителя раствором, содержащим катализатор и активатор с последующей сушкой и прокалкой.
В качестве катализаторов применяют также некоторые минералы или их смеси (алюмосиликаты, оксиды железа, бокситы и т.д. – природные катализаторы).
Дата добавления: 2018-06-27; просмотров: 335; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
