Теоретические основы каталитических процессов
Катализом называется увеличение скорости реакций или возбуждение их при воздействии катализаторов, которые участвуют в химических реакциях, вступая в промежуточное химическое взаимодействие с реагентами, но восстанавливают свой химический состав с окончанием акта катализа.
Обычно катализатор вступает в многократное химическое взаимодействие с реагентами и при этом образуется количество продукта, которое может в 1000 раз превысить массу самого катализатора.
Если термодинамически возможны различные параллельные реакции между исходными веществами, то применение катализатора, ускоряющего одну из возможных реакций, позволяет подавлять остальные и получить такой целевой продукт, который при некаталитической реакции не образуется.
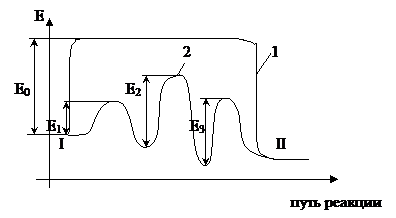 |
Пусть протекает данная одностадийная реакция A+B=R. В присутствии катализатора процесс пойдёт в несколько последовательных стадий:
1) образование промежуточного активированного комплекса
A+Кт=AКт
2) активированный комплекс реагирует со вторым компонентом с образованием комплекса катализатор-продукт
AКт+В= R Кт
3) разложение комплекса катализатор-продукт с образованием продукта реакции и высвобождением катализатора для нового цикла
R Кт= R+ Кт
Каждая из этих последовательных стадий характеризуется своими значениями энергии активации Е1, Е2,Е3, как правило, высота каждого из этих потенциальных барьеров ниже энергии активации некаталитических процессов. Т.о. в присутствии катализаторов реакция протекает по энергетически более выгодному пути—это позволяет проводить процесс с большей скоростью.
Исходное и конечное состояние системы (реакционной) в присутствии катализаторов и без них остаются одинаковыми, поэтому катализатор не может влиять на состояние химического равновесия. Каталитические процессы делятся на две группы: гомогенные (гомо) и гетерогенные (гетеро).
1 группа Гомогенный катализ
Гомогенный катализ может протекать в газовой или жидкой фазе. Механизм гомо катализа состоит в образовании между реагентом и катализатором нескольких промежуточных соединений. Эти соединения находятся в той же фазе, что и продукты реакции.
Процессы гомогенного катализа классифицируются по типу взаимодействия:
- на окислительно-восстановительные;
- кислотно-основное взаимодействие.
Катализаторами растворов служат кислоты, основания, ионы металлов, также вещества, способствующие образованию свободных радикалов.
Механизм кислотно-основного катализа заключается в том, что идёт обмен между протонами и реагирующими веществами. При кислотном катализе проходит сначала от катализатора к реагирующей молекуле, а при основном катализе катализатор служит сначала акцептором протона или донором аниона по отношению к молекуле реагента.
В последней стадии протон перемещается в обратном направлении, и катализатор восстанавливает свой состав.
К ионным относятся окислительно-восстановительные каталитические реакции, ускоряемые ионами металлов.
Газо-фазный катализ может осуществляться по молекулярному и радикально-цепному механизму. При молекулярном механизме каталитической реакции происходит обмен между атомами катализатора и реагирующих веществ. Радикальный механизм гомо катализа возможен как в жидкой фазе, так и в газообразной. Катализатор служит инициатором, направляющим реакцию по цепному механизму. Ускорение достигается в результате появления богатых энергией частиц. Скорость гомо катализа возрастает с повышением концентрации исходных веществ согласно правилу действующих масс.
Основным недостатком гомо катализа является трудность выделения катализатора из конечной смеси, в результате чего часть катализатора теряется безвозвратно, а продукт им загрязняется.
Принципы составления материальных балансов и материальные расчёты необратимых ХТП
Материальный баланс является основой ХТП. К ним можно отнести определение основного и побочного продукта, расходных катализаторов по сырью и производственные потери. Материальный баланс может быть представлен уравнением, левая часть которого составляет масса всех видов сырья и материалов, вступающих в его переработку, а правая – масса производственных продуктов + потери
åG + åG` + åGпот (1)
Основой материального баланса является закон сохранения массы вещества и стехиометрических компонентов. Материальный баланс составляют на единицу массы основного продукта или на единицу времени. Определение массы вводимых компонентов и полученных продуктов производится отдельно для твёрдых, жидких и газообразных фаз согласно уравнению

Теоретический материальный баланс рассчитывается на основе стехиометрического уравнения реакции. Для его составления достаточно знать уравнения реакции и молекулярные массы компонентов.
Практический материальный баланс учитывает состав исходного сырья и готовой продукции, избыток одного из компонентов сырья, степень превращения, потери сырья и готовой продукции. Из данных материального баланса можно найти расход сырья и вспомогательных материалов на заданную мощность аппаратов, а также себестоимость, выходы продуктов, объём реакционной зоны, число реакторов, производственные потери.
Расходные компоненты – величины, характеризующие расход различных видов сырья, воды, топлива, электроэнергии и пара на единицу выработанной продукции. При конструировании аппарата и определении параметров технологического режима создаются условия, при которых рационально сочетается высокая интенсивность и производительность процессов с высоким качеством продукции и более низкой себестоимостью. Для расчёта компонентов необходимо знать все стадии технологического процесса, в результате осуществления которых происходит превращение сырья в готовую продукцию.
| приход | расход | ||||||
| сырьё | кг | м3 | % | продукт | кг | м3 | % |
| G1 G2 G3 | G4 G5 G6 | ||||||
| å | å | ||||||
Дата добавления: 2018-06-27; просмотров: 447; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
