Технико-экономические показатели ХТП. Понятия «степень превращения», «выход продуктов», «селективность процесса».
Литература: 1. Мухленов «ОХТ» 2. «Химия и технология основного органического и нефтехимического синтеза» 3. Кутепов «ОХТ» 4. Мухленов «Расчёты ОХТ»
Введение. Понятие технологии. Химико-технологические процессы. Технико-экономические показатели. Классификация ХТП.
1. Под технологией в широком значении этого слова понимают научное описание методов и средств производства какой-либо промышленности.
Процессы химической технологии включают химическую переработку сырья, основанную на сложных по своей природе химических и физико-химических явлениях.
Технология – наука, изучающая способы и процессы переработки продуктов природы, предметы потребления, средства производства.
2. ХТП, ТЭП
ХТП – это совокупность операций, позволяющих получить целевой продукт из исходного сырья. Некоторые из этих операций необходимы для подготовки исходных реагентов к проведению химических реакций, переводу их в наиболее реакционное состояние.
ХТП складывается из нескольких элементарных процессов и стадий:
1 Подвод реагирующих компонентов в зону реакции
2 Непосредственно химические реакции
3 Отвод из зоны реакции полученных продуктов
1) Совершается путем молекулярной диффузии или конвекции. Для того, чтобы началась химическая реакция, необходимо, чтобы молекулы реагирующих компонентов приблизились друг к другу на расстояние, сравнимое с длиной связи в молекуле. Наиболее быстро это можно достичь интенсивным перемешиванием. В результате перемешивания молекулы всех компонентов равномерно распределяются в объёме, что облегчает диффузию молекул реагирующих компонентов.
|
|
|
2) В реагирующей системе обычно происходит несколько последовательных, а иногда и параллельных химических реакций, приводящих к образованию основного продукта, а также ряд побочных реакций между основными веществами и примесями. При подготовке ХТП учитываются все реакции, которые могут влиять на количество и качество получаемых целевых продуктов.
3) Отбор продуктов может осуществляться также как и подбор реагирующих компонентов, то есть путем диффузии, конвекции или переходом вещества из одной фазы в другую.
Если механизм процесса сложный, принадлежность его к тому или иному классу определяется целенаправленно.
Анализ единичных процессов, из взаимного влияния друг на друга позволяет разработать технологический режим.
Технологический режим – совокупность основных факторов, параметров, влияющих на процесс, выход и качество процессов. Для большинства ХТП основными параметрами являются: температура, давление, применение катализаторов и его активность, концентрация взаимодействующих веществ, способ и степень перемешивания реагентов.
|
|
|
3. Классификация ХТП:
1. По агрегатному состоянию
- гомогенные
- гетерогенные
Гомогенные – это процессы, в которых все реагирующие вещества находятся в одной какой-либо фазе (газовой, жидкой или твердой).
Гетерогенные – это процессы, в которых участвуют вещества, находящиеся в двух или более фазах.
Существуют следующие двухфазные системы: газ-жидкость, газ - твердое вещество, жидкость-жидкость, жидкость-газ, твердое вещество-жидкость.
В гомогенной системе взаимодействие веществ происходит легче, проще механизм всего технологического процесса, следовательно легче управляемость процессов, поэтому на практике, если есть возможность, лучше использовать гомогенные процессы, однако это не всегда удается, в промышленной практике более распространены гетерогенные процессы.
2. При проведении ХТП могут применяться катализаторы, поэтому различают:
- каталитические процессы;
- некаталитические процессы.
Преимущества каталитических процессов: высокая скорость, селективность.
3. По характеру протекания процесса во времени делятся на периодические и непрерывные процессы
|
|
|
Непрерывно действующие реакторы называют проточными, так как через них постоянно протекает поток реагирующей массы
4. По гидродинамическим режимам ХТП делятся на процессы, протекающие по принципу идеального смешения или идеального вытеснения
Идеальное смешение – это режим, при котором с помощью перемешивания достигается одинаковая концентрация веществ в любых точках объёма реактора.
 Идеальное вытеснение – это режим, при котором концентрация веществ плавно изменяется по длине и высоте реактора. Исходная смесь не перемешивается с продуктами, а постепенно проходит через весь аппарат, изменяя свой состав
Идеальное вытеснение – это режим, при котором концентрация веществ плавно изменяется по длине и высоте реактора. Исходная смесь не перемешивается с продуктами, а постепенно проходит через весь аппарат, изменяя свой состав
 |
5. По температурному режиму процессы делятся:
- на изотермические;
- на адиабатические;
- на политермические.
Изотермические процессы – процессы, проходящие при постоянной температуре во всём реакционном объёме
 |
Адиабатические – процессы, протекающие без теплообмена с окружающей средой, такие процессы проводятся обычно в реакторах идеального вытеснения. В таких реакторах температура потока вдоль оси реактора пропорциональна степени превращения исходных веществ и продуктов.
Политермические – процессы, которые в зависимости от условий и времени протекания процесса могут идти как в изотермическом, так и адиабатическом режимах.
|
|
|
 |
6. По тепловому эффекту процессы различают:
- эндотермические;
- экзотермические.
Такое деление имеет особо важное значение при определении влияния теплового эффекта на равновесие и скорость обратимых реакций.
Тепловой эффект реакции в ряде производств определяет технологическую схему производства и конструкцию реактора.
Технико-экономические показатели ХТП. Понятия «степень превращения», «выход продуктов», «селективность процесса».
Для оценки эффективности отдельных этапов процесса необходимо помимо общих экономических показателей используют такие критерии эффективности, которые более полно отражали бы химическую и физико-химическую сущность явлений, происходящих в отдельных аппаратах технологической схемы. В качестве таких показателей принято прежде всего использовать степень превращения исходного реагента, выход продукта и селективность. Они с разных сторон характеризуют полноту использования конкретной химической реакции.
1. Степень превращения – это количество исходного реагента, использованного на химическую реакцию. Определяют по основному веществу. Основным исходным веществом, по которому ведется расчёт называют наиболее дорогое из всех веществ, которые присутствуют в исходной смеси.

где GН – количество реагента в исходной реакционной смеси;
GК – количество реагента в реакционной смеси, выходящей из аппарата или находящегося в реакторе;
DG – изменение количества реагента в ходе химической реакции.
Селективностью процесса называют отношение количества основного исходного вещества, превратившегося в целевой продукт к общему количеству превратившегося вещества.
аА + вВ ® dD + nN

где GА®D – количество основного исходного вещества А, превратившегося в целевой продукт D;
GА®N – количество основного исходного вещества А, превратившегося в побочный продукт N
Степень превращения
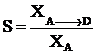
Эффективность сильно зависит от количества побочных продуктов.
На избирательность процесса могут влиять многие параметры технологического режима.
Время пребывания, температура, давление, концентрация исходных реагентов, степень перемешивания реакционной смеси и избирательность катализатора.
Выход продуктов
Степень превращения характеризуют эффективность процесса с точки зрения использования исходного сырья, но этой величины не всегда достаточно для характеристики процессов с точки зрения продуктов реакции.
Выходом продукта называют отношение количества фактически полученного продукта Gф к максимальному количеству продукта Gм, которое могло бы получиться из исходного вещества

(1)
Для химических реакций максимальное количество продукта определяется по уравнению реакций.
Для процессов межфазной массопередачи (абсорбции, испарения, десорбции и др.) за максимальное принимается всё количество продукта, которое имеется в отдающей фазе (в газе при адсорбции).
Такой выход продукта применительно к химическим реакциям обычно называют степенью превращения, а при гетерогенных каталитических реакциях выход продукта называют степенью контактирования. В процессах массопередачи выходом называют степень межфазного перехода.
Если в числителе уравнения подставляется количество продукта, полученного в состоянии равновесия, то выход называется равновесным или теоретическим. Для необратимых процессов, у которых может происходить полное химическое превращение или полный переход вещества из одной фазы в другую то Хр = 1.
Для обратимых процессов равновесный выход, совпадающий с равновесной степенью превращения, всегда ХР <1, т.к. равновесие наступает при неполном превращении исходных веществ в продукт. Равновесный выход ХР обычно вычисляют используя таблицы значений констант равновесия.
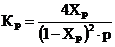
. (2)
Р – давление
А + В = D
А + В = 2D (3)

Для определения степени приближения процесса равновесию применяют выход от теоретического или фактический выход ХФ
ХФ является более точной оценкой
Выходом от теоретического называют отношение количества фактически полученного продукта к продукту, которое могло бы получиться в состоянии равновесия.

Фактический выход всегда < 1 и лишь в пределе ® 1
аА + вВ ® dD
1. Если исходные вещества А и В взяты в стехиометрических соотношениях и реакция необратима, тогда
GDтеор = GA + GB

а фактический выход

Используя то положение, что количество вещества в однородной реакционной системе равно произведению его концентрации на объём всей многокомпонентной реакционной системы
Gi = Ci × V
можно замерить только концентрации всех веществ А, В и D и вычислить фактический выход как отношение весовых концентраций

Если в необратимой реакции взят избыток вещества А, то при прочих равных условиях повысится выход по отношению к веществу В и понизится по отношению к А. Этим приёмом часто пользуются в промышленности, повышая выход по более ценному исходному веществу В за счёт увеличения расхода дешёвого вещества А



где G`B – количество, основанное на основе стехиометрии реакции по фактическому количеству введённого в систему вещества А
G`А – рассчитано по действительному значению вещества В
Степень превращения вещества А и В в вещество D для газовых синтезов рассчитывается по формуле:


где Р – парциальное давление или объёмные концентрации соответствующих газов
Если реакция (1) обратима, А и В введены в систему в стехиометрических соотношениях, то:
GD равн < GA + GB
и теоретический выход продуктов

а выход от теоретического больше степени превращения

Дата добавления: 2018-06-27; просмотров: 1946; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
