Гетерогенный катализ. Стадии гетерогенного катализа.
Влияние технологических параметров на гетерогенные каталитические процессы
Подавляющее большинство известных промышленных гетерогенных каталитических процессов связаны на реакциях между газообразными веществами с участием твёрдых катализаторов.
Есть несколько теорий, объясняющих процесс катализа. Каждая из них объясняет ускоряющее действие твёрдых катализаторов. Из большинства теоретических положений видно, что важную роль для катализа имеют активные центры, т.е. неоднородные участки поверхности, обладающие повышенной активностью.
Общим для всех теорий катализа является образование на поверхности твёрдого катализатора промежуточного соединения, кот. не образует отдельных фаз и не обнаруживается хим.анализом. строение этого соединения можно представить в виде активного комплекса определенного геометрического образования – хим.соединения с участием свободных электронов катализатора. Свойства промежуточного соединения определяет направление процесса, а если процесс протекает в кинетической области, то скорость реакции для цепных реакций катализ имеет гетерогенно-гомогенный характер, т.е. на поверхности катализатора возникает радикал (гетерогенная стадия), кот. возбуждает цепную реакцию в объеме газа или жидкости (гомогенная стадия).
Каталитическая активность твёрдых пористых катализаторов определяется как их хим.составом, так и пористой структурой, под кот подразумевают совокупность форм зерен объем, размер и внутренние поверхности зерна.
|
|
|
Активность катализатора пропорциональна поверхности доступной для реагентов. В тонкопористых катализаторах внутренняя поверхность может быть использована далеко не полностью (диффузионное торможение).
Процесс гетерогенного катализа на твёрдых пористых катализаторах состоит из следующих стадий:
1. диффузия реагирующих веществ из ядра потока к поверхности зерен катализатора;
2. диффузия реагентов в порах зерна катализатора;
3. активированная адсорбция (хемосорбция) на поверхности катализатора с образованием поверхностных хим. соединений (реагент - катализатор);
4. перегруппировка атомов с образованием поверхностных комплексов (продукт - катализатор);
5. десорбция продукта с поверхности активных центров;
6. диффузия продукта в порах зерна катализатора;
7. диффузия продукта от поверхности зерна катализатора в ядро потока.
Общая скорость гетерогенного каталитического процесса определяется относительными скоростями отдельных стадий и может лимитироваться самой медленной. В зависимости от определяющей стадии различают каталитические процессы, происходящие в кинетической, внешне-диффузионной и внутри-диффузионной областях.
|
|
|
1. В кинетической области контакта скорости процесса не зависят от коэффициента диффузии. Кинетическое уравнение должно учитывать влияние основных технологических параметров на скорость каталитического процесса
 (1)
(1)
где k0 – const скорости реакции;
∆р – парциальное давление реагентов;
Р – безразмерное давление, равно отношению рабочего Р к атмосферному:
 ;
;
n – общий
β0 – коэффициент пересчета к нормальному Р и Т.
В кинетической области протекают процессы на малоактивных кат-рах с малыми размерами зерен и крупными порами при турбулентном режиме потока реагентов и низких температурах. Увеличение скорости достигается, в основном, увеличением температуры. Общая скорость процесса определяется соотношением третьей и пятой стадии.
2. Во внешне-диффузионной области (лимитирует 1 или 7 стадия) скорость процесса определяется коэффициентами диффузии реагентов и продуктов реакции. Скорость определяется:

где G – масса вещества, перенесённое за время τ в направлении z перпендикулярно поверхности зерна при концентрации с компонента в ядре потока реагентов;
|
|
|
S – свободная поверхность зёрен катализатора;
Dэ – эффективный коэффициент диффузии;
λ – длина свободного пробега молекул.
В этой области происходят процессы на высокоактивных катализаторах, обеспечивающих большую скорость хим. р-ций. Для ускорения применяют высокие линейные скорости потоков.
3. Во внутри-диффузионной области общая скорость кат. Процесса лимитируется скоростью диффузии реагентов в порах катализатора. Время, необходимое для диффузии газообразных компонентов в поры катализатора на глубину l можно определить по формуле Эйнштейна:

При 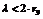 , где rэ – эквивалентный радиус пор, то Dэ определяют как коэффициент молекулярной диффузии. Если
, где rэ – эквивалентный радиус пор, то Dэ определяют как коэффициент молекулярной диффузии. Если 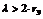 , то Dэ определяют по формуле Кнудсена:
, то Dэ определяют по формуле Кнудсена:

где М – молекулярная масса.
Внутри - диффузионная область характерна для проведения катализа в фильтрующем слое катализатора. Каталитические процессы во внутри - диффузионной области можно ускорить уменьшением размера зёрен катализатора и увеличением радиуса пор. При увеличении размера пор уменьшается их количество и соответственно внутренняя поверхность, поэтому необходимо найти оптимум между размером пор и внутренней поверхностью.
|
|
|
При наличии катализатора определённого состава и структуры, большое значение имеет температурный режим процесса. Существует 2 вида процессов – экзотермический и эндотермический. Выход продукта эндотермической реакции непрерывно увеличивается с увеличением температуры. Для обратимых экзотермических реакций с повышением температуры равновесный выход продуктов уменьшается и увеличивается при низких температурах.
Значение максимального выхода и соответствующее ему значение оптимальной температуры изменяются в зависимости от активности катализатора и концентрации реагирующих веществ.
График – Зависимость выхода продукта от температуры при различном времени контактирования.

 . Изменяется только температура и время контактирования, остальные технологические параметры постоянны. Оптимальная кривая проходит через максимумы.
. Изменяется только температура и время контактирования, остальные технологические параметры постоянны. Оптимальная кривая проходит через максимумы.
Соединив максимальные выходы, можно получить оптимальную кривую, показывающую, что с увеличением времени контакта и выходов следует понижать температуру для достижения максимальной скорости процесса и степени превращения.
График – Зависимость выхода продукта от температуры для катализаторов различной активности.

A1>A2>A3>A4
Т1,Т2,Т3,Т4 – температуры зажигания для 4-ёх различных катализаторов.
Увеличение концентрации реагентов и давления изменяет выход продукта и температуру зажигания. Сложным может быть влияние температуры на каталитические процессы, в которых увеличение температуры до некоторого предела вызывает протекание вредных побочных реакций. При этом необходимо анализировать влияние температуры на каждую реакцию в отдельности.
Дата добавления: 2018-06-27; просмотров: 1936; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
