ПРЕДЕЛЬНЫЕ И НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
Цель работы: ознакомление с предельными и непредельными углеводородами; особенностями строения и химических свойств алканов, алкенов и алкинов и их производных; проведение химических реакций для подтверждения строения и свойств изучаемых соединений.
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Предельные углеводороды, алканы
Общие сведения, номенклатура предельных углеводородов
Общая формула предельных углеводородов -  .Первые четыре вещества этого ряда имеют исторически сложившиеся названия. Названия углеводородов, начиная с пентана, образованы от греческих названий чисел. Для наименования предельных углеводородов принят суффикс –ан. Предельные углеводороды образуют гомологический ряд.
.Первые четыре вещества этого ряда имеют исторически сложившиеся названия. Названия углеводородов, начиная с пентана, образованы от греческих названий чисел. Для наименования предельных углеводородов принят суффикс –ан. Предельные углеводороды образуют гомологический ряд.
Таблица 4. Гомологический ряд алканов.
| Углеводороды | Формула | Температура (°С) | |
| плавления | кипения | ||
| Метан | СН4 | -182 | -162 |
| Этан | С2Н6 | -183 | -89 |
| Пропан | С3Н8 | -187 | -42 |
| Бутан | С4Н10 | -138 | -0,5 |
| Пентан | С5Н12 | -130 | +36 |
| Гексан | С6Н14 | -95 | +69 |
| Гептан | С7Н16 | -91 | +98 |
| Октан | С8Н18 | -57 | +126 |
| Нонан | С9Н20 | -54 | +151 |
| Декан | С10Н22 | -30 | +174 |
Физические свойства алканов
При обычных условиях С1-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле. Так, метан СН4 (болотный, рудничий газ) – газ без цвета и запаха, хорошо растворимый в этаноле, эфире, углеводородах, но плохо растворимый в воде.
|
|
|
Метан используют в качестве высококалорийного топлива в составе природного газа, в качестве сырья для производства водорода, ацетилена, хлороформа и других органических веществ в промышленных масштабах.
Пропан С3Н8 и бутан С4Н10 – газы, применяемые в быту, в качестве балонных газов, за счет легкой сжижаемости. Пропан используется в качестве автомобильного топлива, поскольку является более экологически чистым, чем бензин. Бутан – сырье для получения 1,3 –бутадиена, использующегося в производстве синтетического каучука.
Получение алканов
Алканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска.
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают из битумного угля:
nC + (n+1)H2 = CnH2n+2
или по реакции Фишера-Тропша :
nCO + (2n+1)H2 = CnH2n+2 + H2O
К лабораторным способам получения алканов относят:
1. Гидрирование непредельных углеводородов при нагревании и в присутствии катализаторов (Ni, Pt, Pd):
R1-C≡C-R2 (алкин) → R1-CH = CH-R2 (алкен) →
|
|
|
→ R1-CH2 – CH2 -R2 (алкан)
2. Взаимодействие воды с металлоорганическими соединениями:
R-Cl + Mg → R-Mg-Cl + H2O → R-H (алкан) + Mg(OH)Cl
3. Электролиз карбоновых кислот:
CH3COONa ↔ CH3COO— + Na+
2CH3COO— → 2CO2↑ + C2H6 (этан)
4. Реакция декарбоксилирования:
CH3COONa + NaOH → CH4 + Na2CO3
5. Реакция Вюрца:
R1-Cl +2Na +Cl-R2 →2NaCl + R1-R2
и многие другие способы.
Химические свойства алканов
В молекулах предельных углеводородов все атомы углерода находятся в состоянии sp3- гибридизации атомных орбиталей. Каждый атом углерода затрачивает на соединение с любым соседним атомом углерода не более одной валентности, причем все свободные (не затраченные на соединение с атомами углерода) его валентности насыщены водородом. Поэтому они не вступают в реакции присоединения. При обычных условиях алканы химически инертны, они не взаимодействуют с концентрированными серной и азотной кислотами, щелочами, перманганатом калия. Русский химик М.И. Коновалов назвал алканы «химическими мертвецами». Устойчивость объясняется прочностью связей и их неполярностью.
Предельные углеводороды не склонны к реакциях разрыва связи (реакция присоединения), для них свойственно замещение.
1. Галогенирование алканов. Под воздействием кванта света начинается радикальное замещение (хлорирование) алкана. Общая схема:
|
|
|
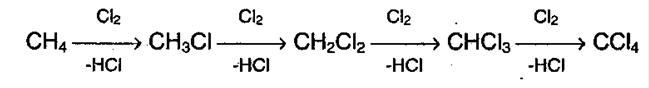
Реакция идет по цепному механизму, в которой различают:
а) Инициирование цепи:
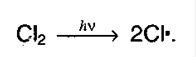
б) Рост цепи:
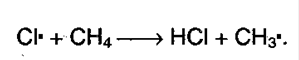
в) Обрыв цепи:
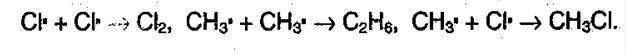
Суммарно можно представить в виде:
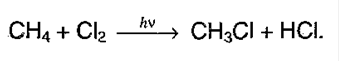
2. Нитрование(реакция М.И.Коновалова)алканов. Реакция протекает при 140 °С при действии 12-14% азотной кислоты:
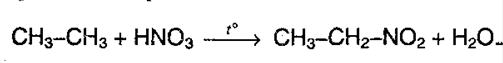
Легче всего реакция протекает с третитичным атомом углерода, чем с первичным и вторичным.
3. Изомеризация алканов. При конкретных условиях алканы нормального строения могут превращаться в разветвленные:
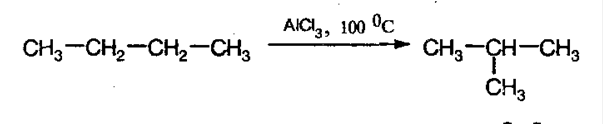
4. Крекинг алканов. При действии высоких температур и катализаторов высшие алканы могут рвать свои связи, образуя алкены и алканы более низшие:
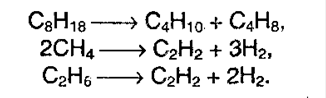
5. Окисление алканов. В различных условиях и при разных катализаторах окисление алкана может привести к образованию спирта, альдегида (кетона) и уксусной кислоты. В условиях полного окисления реакция протекает до конца – до образования воды и углекислого газа:

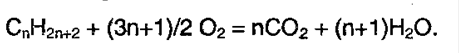
Дата добавления: 2018-05-13; просмотров: 3757; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
