Реакции гидроксильной группы, протекающие с разрывом связи углерод-кислород
1) Замещение гидроксила на галоген с образованием галогенопроизводных. Происходит при взаимодействии спиртов с реактивами, содержащими галоген, например, PCl5, PCl3, SOCl2:
С2Н5ОН + SOCl2 → C2H5Cl + HCl + SO2
этанол тионилхлорид хлорэтан
2) Дегидратация спиртов (отщепление воды)
а) Внутримолекулярная дегидратация приводит к образованию этиленовых углеводородов, её проводят в присутствии водоотнимающих средств (Н2SO4, Н3PO4, силикагель) при температуре выше 140 0С.
CH3-CH2-OH → CH2═CH2 + H2O
этанол этилен
У более сложных спиртов водород отщепляется от наименее гидрогенизированного атома углерода (в соответствии с правилом Зайцева).
Правило А.М.Зайцева: в реакциях дегидратации и дегидрогалогенирования водород отщепляется от наименее гидрогенизированного атома углерода соседнего с углеродом, содержащим галоген или гидроксил.
б) Межмолекулярная дегидратация. Происходит отщепление воды от двух молекул спирта, при этом образуются простые эфиры. Реакция протекает в присутствии водоотнимающих средств в качестве катализаторов, например, концентрированной H2SO4, при температуре от 100 до 140 0С.
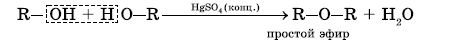
Реакции окисления предельных одноатомных спиртов
При окислении первичных спиртов образуются альдегиды, вторичных – кетоны, третичных – смесь карбоновых кислот. Образование различных продуктов при окислении первичных, вторичных и третичных спиртов дает возможность использовать эту реакцию для установления строения спирта.
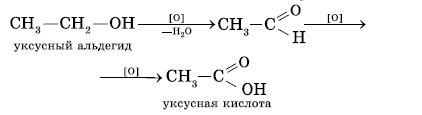
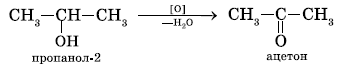
Третичные спирты наиболее стойки к действию окислителей. Это объясняется тем, что углеродный атом третичного спирта не содержит атомов водорода и окисление такого спирта при действии энергичных окислителей и высокой температуре приводит к разрушению молекулы с образованием смеси карбоновых кислот.
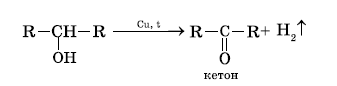
Реакции дегидрирования предельных одноатомных спиртов спиртов
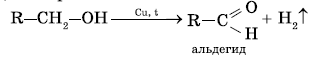
При пропускании паров спирта над катализатором дегидрирования (раскаленная медь, железо, никель) при t=250 °C первичные и вторичные спирты отщепляют по два атома водорода. При этом первичные спирты превращаются в альдегиды, а вторичные спирты в кетоны.
Многоатомные спирты
Многоатомные спирты можно рассматривать как производные углеводородов, в которых несколько атомов водорода замещены на группы -ОН. Двухатомные спирты, называются диолами или гликолями, трехатомные – триолы или глицерины.
Названия многоатомных спиртов образуются по общим правилам номенклатуры ИЮПАК. Представителями многоатомных спиртов являются:
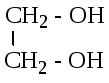 этандиол-1,2
этандиол-1,2 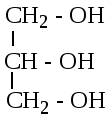 пропантриол-1,2,3
пропантриол-1,2,3
Этиленгликоль глицерин
Многоатомные спирты – это вязкие жидкости, сладкого вкуса, хорошо растворимые в воде и этаноле, плохо – в других органических растворителях. Этиленгликоль сильный яд.
Дата добавления: 2018-05-13; просмотров: 653; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
