Предельные одноатомные спирты
Для предельных одноатомных спиртов характерна изомерия углеродного скелета (начиная с бутанола), а также изомерия положения гидроксильной группы (начиная с пропанола) и межклассовая изомерия с простыми эфирами.
Общая формула гомологического ряда предельных одноатомных спиртов CnH2n+1OH . По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой.
СН3-СН2-СН2-СН2-ОН (бутанол – 1)
СН3-СН(СН3)- СН2-ОН (2-метилпропанол – 1)
СН3-СН(ОН)-СН2-СН3 (бутанол – 2)
СН3-СН2-О-СН2-СН3 (диэтиловый эфир)
Физические свойства предельных одноатомных спиртов
Низшие спирты (до С15) – жидкости, высшие – твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Спирты имеют высокие температуры кипения и плавления за счет образования водородных связей.
Таблица 8. Гомологический ряд температуры кипения предельных одноатомных спиртов
| Название спирта | Формула | Температура кипения (°С) |
| Метиловый (метанол) | CH3—OH | 64,7 |
| Этиловый (этанол) | CH3—CH2—OH | 78,3 |
| Пропиловый (пропанол-1) | C3H7—OH | 97,2 |
| Бутиловый (бутанол-1) | C4H9—OH | 117,7 |
| Амиловый (пентанол-1) | C5H11—OH | 137,8 |
| Гексиловый (гексанол-1) | C6H13—OH | 157,2 |
| Гептиловый (гептанол-1) | C7H15—OH | 176,3 |
Получение спиртов предельных одноатомных спиртов
Получение спиртов возможно с помощью биотехнологического (брожение) способа из древесины или сахара.
К лабораторным способам получения спиртов относятся:
1. Гидратация алкенов (реакция протекает при нагревании и в присутствии концентрированной серной кислоты)
СН2 = СН2 + Н2О → СН3ОН
2. Гидролиз алкилгалогенидов под действием водных растворов щелочей
СН3Br + NaOH → CH3OH + NaBr
СН3Br + Н2О → CH3OH + HBr
3. Восстановление карбонильных соединений
CH3-CH-O + 2[H] → CH3– CH2-OH
4. Единственным промышленно важным методом синтеза метанола является каталитическая реакция между оксидом углерода (II) и водородом.
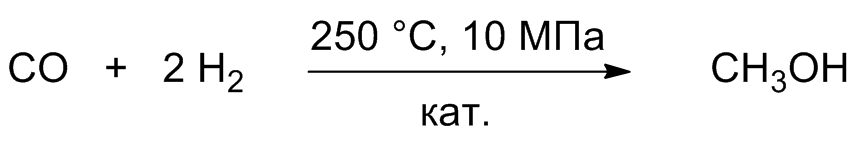
Химические свойства предельных одноатомных спиртов
Химические свойства предельных одноатомных спиртов определяются наличием гидроксильной группы. В химических реакциях особое место принадлежит двум типам реакций:
- с разрывом связи О—Н (энергия разрыва связи 429 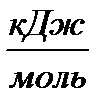 );
);
- с разрывом связи С—ОН (энергия разрыва связи 360 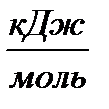 ).
).
Реакции, протекающие с разрывом связи кислород-водород
Спирты – очень слабые кислоты. Кислород оттягивает на себя общую электронную плотность с водородом, вызывая поляризацию связи Oδ-←Hδ+. Поэтому возможно замещение атома водорода в спирте на металлы и радикалы:
1) Замещение водорода на металл (Na, K) с образованием алкоголятов - твердых веществ белого цвета.
2СН3—СН2—ОН + 2Na→2СН3— СН2—ОNa + H2
этиловый спирт этилат натрия
Строение углеводородного радикала существенно влияет на подвижность атома водорода в гидроксильной группе. Легче всего замещается водород в метаноле, трудней всего в третичных спиртах.
Сила спиртов определяется подвижностью атома водорода, его способностью замещаться на металл, его окислительными свойствами, она в ряду уменьшается: метанол > этанол > изопропанол > трет-бутанол.
2) Взаимодействие спиртов с магнийорганическими соединениями. При этом образуются углеводород и производные спиртов - алкоголяты. Реакция используется для количественного определения спирта по объему выделившегося метана:
С2Н5ОН + СН3—MgI → СН4 ↑ + С2Н5—О—Mg—I
этиловый спирт метилмагниййодид метан этоксимагниййодид
3) Образование простых эфиров.Взаимодействие алкоголятов с галогеналкилами:
С2Н5—О—Na + I—С2Н5 → С2Н5—О— С2Н5
этилат натрия йодистый этил диэтиловый эфир
Эта реакция не является химическим свойством спирта, но на ее примере можно видеть способность к замещению водорода в спирте на углеводородный радикал, с образованием простого эфира.
4) Образование сложных эфиров (реакция этерификации).Сложные эфиры можно рассматривать как продукты замещения водородного атома в гидроксильной группе на остаток карбоновой кислоты R’COO-, который называется ацил, например, для уксусной кислоты - ацетил, для муравьиной – формил, для пропионовой - пропионил.
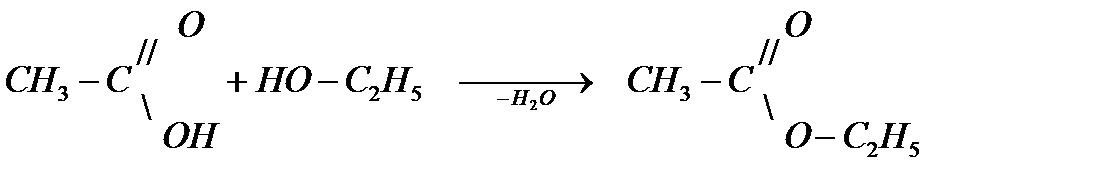
уксусная кислота этиловый спирт уксусноэтиловый эфир
· Важно запомнить, что выделяющаяся при этерификации молекула воды образуется из гидроксила кислоты и водорода спирта, а не наоборот. Это было установлено методом "меченых атомов": в молекулу спирта был введен изотоп кислорода 18О, который затем был обнаружен в молекуле сложного эфира.
Дата добавления: 2018-05-13; просмотров: 1056; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
