БИОТЕХНОЛОГИЧЕСКИЕ МЕТОДЫ ПОЛУЧЕНИЯ НАТУРАЛЬНЫХ ПИЩЕВЫХ КРАСИТЕЛЕЙ
Каротиноиды из растительного сырья. Благодаря наличию интенсивной окраски каротиноиды широко применяют в качестве пищевых красителей. Антиокислительные, противоопухолевые и провитаминные свойства каротиноидов дают возможность улучшить качество пищевых продуктов.
Главным источником каротиноидов являются различные виды растительного сырья (томаты, ягоды бересклета), где эти соединения находятся в виде комплексов. Природные комплексы каротиноидов обладают более высокими стабильностью, биологической активностью и усвояемостью, чем индивидуальные продукты химического синтеза.
Существующие способы выделения препаратов каротиноидов из растительного сырья немногочисленны ив большинстве своем основаны на прямой экстракции целевого компонента маслами или органическими растворителями. Сложность выделения каротиноидов заключается в том, что представители этого класса соединений находятся в растительном сырье в ассоциации с различными биополимерами.
Применение в пищевой промышленности препаратов каротиноидов ограничено гидрофобностью этих пигментов. Повышения гидрофильности возможно достигнуть путем сорбции каротиноидов на гидрофильный агент (пектин, белок и т. д.). Введение каротиноидов в пищевые продукты в сорбированном на биополимерах виде позволяет повысить пищевую ценность изделий, обогатить их цветовую гамму и значительно расширить сферу применения гидрофобных пигментов.
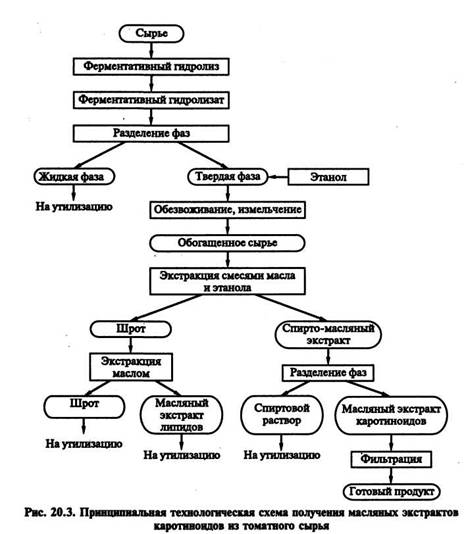
Основными нелипидными компонентами томатного сырья, с которыми связаны каротиноиды, являются целлюлоза, гемицеллюлоза, пектин, белок, в соответствии с этим в качестве гидролизующих агентов используют ферментные препараты с пек-толитической, целлюлолитической и протеолитической активностями.
Гидролиз проводят при гидромодуле 1:5, температуре 50 °С, дозировке ферментных препаратов 0,5 % СВ сырья в течение 3 ч при периодическом перемешивании реакционной смеси.
В процессе ферментативного гидролиза расщепляются полимерные компоненты сырья. Низкомолекулярные продукты гидролиза переходят в жидкую фазу ферментативного гидролизата, а десорбированные с расщепленных полимеров каротиноиды ресорбируются на негидролизованных компонентах сырья. В результате изменяется коэффициент распределения каротиноидов между жидкой и твердой фазами.
Концентрирование на поверхности твердой фазы каротиноидов при одновременном увеличении потерь СВ сырья позволяет существенно повысить степень обогащения сырья целевым компонентом при проведении ферментативного гидролиза. При этом содержание каротиноидов в твердой фазе ферментативного гидролизата возрастает в 7,5—11 раз по сравнению с их количеством в исходном продукте, чем достигается обогащение сырья.
Выделение каротиноидов проводят смесями 96%-го этанола и обезличенного подсолнечного масла при соотношении обогащенное сырье: этанол: масло = 1:2:2 в течение 20 мин при 78 °С. Из шрота после спиртово-масляной экстракции проводят повторноевыделение биологически активных липидов маслом в течение 20 мин при 80 °С и равном соотношении реагентов.
При использовании в качестве гидролизующих агентов препаратов Целлюлаза 100 и Пектофоетидин П10Х выход каротиноидов в масло возрастает в 1,6—2,3 раза (за исключением обработки сухой томатной кожуры Пектофоетидином П10Х) по сравнению с выходом при прямой экстракции и составляет в зависимости от вида сырья 79—88 % их содержания в исходном продукте. Целлюлазу 100 (Ц100) рекомендуют использовать для ферментативного гидролиза томатной пасты, свежих томатных выжимок, томатной кожуры, а Пектофоетидин П10Х (ПФ П10Х) — для ферментативной обработки свежих томатов и томатной мякоти.
Выход каротиноидов зависит от вида томатного сырья и соотношения компонентов реакционной смеси (табл. 20.2). Оптимальным из испытанных является вариант соотношения обогащенное сырье: этанол: масло =1:2:2, при котором в масляную фазу экстракта переходит не менее 62 % каротиноидов сырья. Концентрация целевого компонента составляет 76 мг/100 см3.

Выход каротиноидов в масляный экстракт при проведении предварительной обработки ферментами составляет не менее 80 %.
Препараты каротиноидов из томатного сырья интенсивного красного цвета, без запаха, со слабым перечным привкусом.
Масляные экстракты каротиноидов достаточно устойчивы при хранении. Экстракты из сырья, подвергнутого ферментативной обработке, более устойчивы по сравнению с их аналогами из необработанного ферментами сырья.
Схема получения масляных экстрактов каротиноидов из различных видов томатного сырья включает две основные стадии: обогащение сырья и экстракцию целевого компонента из обогащенного продукта (рис. 20.3).
Сорбаты каротиноидов на пектине АМ-201 (100 мг/г сорбента) темно-рыжего цвета, без запаха и вкуса. Препараты хорошо растворяются в воде, изменяя свою окраску на оранжевую. Сухие сорбаты каротиноидов томата и их водные растворы достаточно стабильны — после хранения в течение 70 сут содержание растительных каротиноидов составило не менее 78 % исходного. Сохранность каротиноидов в водном коллоидном растворе сорбата выше, чем в сухом препарате.
На территории России произрастает много растений, плоды которых содержат достаточные количества биологически активных соединений — каротиноидов, антоцианов, токоферолов. Выделение каротиноидов и антоцианов из этих плодов проводят способом, аналогичным описанному ранее для томатного сырья. Результаты, представленные в таблице 20.3, показывают, что для исследованных видов характерно преобладание одного класса пигментов — каротиноидов или антоцианов.

Наиболее богатый источник каротиноидов — ягоды бересклета (107мг/100см3). Этот вид сырья характеризуется также высоким содержанием токоферолов (378 мг/100 г), что особенно ценно. Высокое содержание антоцианов отмечено у ягод барбариса и аронии (657 ед. ОП/г и 1932 ед. ОП/г соответственно).
Каротиноиды из микробной биомассы. Ликопин — красный пигмент плодов томата, относится к природным соединениям группы каротиноидов. Это пигмент, который придает красную окраску овощам и фруктам, таким, как помидоры, арбузы, розовые грейпфруты и др. Его широко применяют в качестве пищевого красителя при изготовлении продуктов питания, особенно при производстве колбас и ветчинных изделий, где он может заменить нитрит натрия. Исследования последних лет свидетельствуют о том, что ликопин наряду с красящей функцией имеет самостоятельное значение как биологически активная добавка. Ликопин оказывает общеукрепляющее действие на организм и обладает множеством ценных фармакологических свойств. Подавляя в организме свободнорадикальное окисление, ликопин стабилизирует иммунный статус организма, улучшает протекание ряда важнейших биологических процессов в организме, в том числе нормализует уровень глюкозы в крови, липидный обмен, зрение и контролирует новообразование клеток.
В условиях растущей потребности в ликопине особую важность приобретает проблема изыскания его новых источников.
До сих пор основным источником ликопина являются растения, в частности специально отселекционированные сорта томатов Lycopersicon sp. Однако очень низкий выход (0,3—0,4 мг/г сырья), сезонность, действие неблагоприятных погодных факторов и фитопатогенов делают этот способ экономически неэффективным. Один килограмм такого ликопина стоит около $5000 США. Высокая цена и дефицит ликопина на рынке — основные причины отсутствия необходимого человеческому организму антиоксиданта в ежедневном рационе питания.
Решение указанных проблем возможно путем создания биотехнологического способа получения ликопина.
Способность синтезировать ликопин обнаружена у различных видов микроорганизмов, но наиболее активным продуцентом является гриб Blakeslea trispora. В результате многоступенчатой селекции и отбора получена пара штаммов гриба Blakeslea trispora ВСБ-129 (-) и ВСБ-130 (+), обладающих сверхспособностью к синтезу ликопина.
Сотрудниками ГосНИИсинтезбелок оптимизированы состав питательной среды, время выращивания, соотношение (+) и (—) форм при совместном культивировании. Установлено, что на среде с глюкозой через 36 ч накапливается до 35 мг/г АСВ ликопина, а на кукурузно-соевой среде через 48 ч — до 30 мг/г АСВ. При этом в отличие от известных, используемых на практике штаммов гриба BL trispora селекционированные штаммы синтезируют ликопин без добавления в среду предшественников и стимуляторов образования ликопина, а сумма ликопина составляет 95—98 % ка-ротиноидов.
Состав оптимизированной питательной среды, г/дм3: гидрол (зеленая патока) — 66,5; кукурузный экстракт — 81; (NH4)2SO4 — 1,281; К2НРО4 — 4,1.
На основании проведенных исследований разработана принципиальная технологическая схема получения ликопинсодержащей биомассы (рис. 20.4).
Масляную экстракцию ликопина из биомассы проводят в три ступени при 55 °С в течение 45 мин каждую.

Ликопин, как было отмечено, имеет немаловажное значение в пищевой промышленности. При этом наряду с жирорастворимой формой существует большая потребность в водорастворимой форме ликопина.
Получение водорастворимого ликопина осуществляется смешиванием жирорастворимого ликопина с фракцией фосфолипидов, полученной при комплексной переработке биомассы гриба В1. trispora. При смешивании в определенном соотношении полученный продукт приобретает вододисперсионную форму. Согласно данному методу при смешивании с водой фосфолипиды образуют так называемые мицеллы, в которые включаются кристаллы ликопина. Преимущество данного метода заключается в том, что фосфолипиды, которые, как и ликопин, обладают ценными биологическими свойствами, можно получать совместно с ним в одном технологическом процессе.
Поскольку в составе липидов исследуемого гриба помимо ликопина обнаружены и другие ценные компоненты, экстракцию проводят в мягких условиях (t = 50...55 °С), чтобы в дальнейшем, после выделения ликопина, оставшуюся часть биолипидного комплекса можно было использовать для переработки. При этом получают кристаллы ликопина с чистотой до 95 % и коэффициентом извлечения 0,67.
Работы в области поиска пищевых красителей на основе каротиноидов привели к обнаружению нового природного источника этих соединений — микроскопической водоросли Dunaliella sabina, которая рекомендована для использования в европейских странах. β-Каротин, выделенный из этой водоросли, придает пищевым продуктам оттенки от золотисто-желтого до оранжевого цвета.
Пищевые красители различной химической структуры из растительного сырья. Шиконин — нафтохиноновый пигмент красного цвета, широко используют в Китае, Корее, Японии как краситель и лекарственный препарат. В настоящее время фирма «Allok» (Германия) включила шиконин в список пищевых красителей.
В Институте биоорганической химии РАН проведено сравнение спиртового и масляного экстрактов из клеточной культуры A. euchroma, потенциальных источников пищевого красителя шиконина, по антимикробной активности и стабильности окраски.
Антимикробную активность препаратов изучали на суточных культурах Staphylococcus aureus, Bacillus cereus, Escherichia coli, Pse-udomonas aeruginosa, Candida sp.
Выяснено, что масляные и спиртовые экстракты из A. euchroma обладают высокой антимикробной активностью, а по сравнению с раствором чистого препарата шиконина более активно подавляют рост грамположительных бактерий и дрожжей рода Candida.
Таким образом, использование спиртового и масляного экстрактов из A. euchroma в качестве пищевого красителя позволяет одновременно увеличивать срок хранения продуктов благодаря высокой антимикробной активности предлагаемых препаратов.
В целом массовое производство пищевых красителей на основе использования методов биотехнологии считается наиболее перспективным во всем мире.
Возможна интенсификация процессов выделения и других пищевых красителей из природного сырья с помощью ферментных препаратов микробного происхождения.
Например, разработан способ получения красного пищевого красителя из сока, выжимок и непосредственно из измельченной краснокочанной капусты среднепоздних сортов. Сырье стерилизуют и подвергают воздействию гемицеллюлазных ферментов гриба A. niger. После окончания гидролиза выжимки отделяют, а гидролизат фильтруют и упаривают. Полученный краситель устойчив к действию микрофлоры листьев капусты.
В МГУПП разработан способ получения натуральных пищевых красителей путем обработки отходов переработки свеклы, апельсинов и крапивы ферментными препаратами:
• Поликанесцином, обладающим β-галактозвдазной (1300 ед/г), ксиланазной (1100 ед/г) и β-глюканазной (460 ед/г) активностями. Оптимальные условия действия препарата: температура 30...45 °С, рН 3-5;
• Лизофунгином, обладающим β-глюканазной (1800 ед/г), целлюлазной (90 ед/г) и ксиланазной (40,5 ед/г) активностями. Оптимальные условия действия: температура 45...55 °С, рН 6,5—7;
• Целловиридином, обладающим β-глюканазной (450 ед/г), целлюлазной (2000 ед/г) и ксиланазной (800 ед/г) активностями. Оптимальные условия действия: температура 45...50°С, рН 4,5-5,5.
Растворы ферментных препаратов использовали как для непосредственной экстракции ферментов, так и для предварительной обработки сырья при оптимальных условиях действия ферментов.
Установлено, что оптимальной концентрацией спирта для выделения красящих веществ из отходов переработки свеклы (бетанин) является 40 %, отходов переработки апельсинов (каротиноиды) — 70, крапивы (хлорофилл) — 80 %. Время ферментативной предобработки — 20 мин; время экстракции — 1ч. Интенсивность окраски экстрактов определяется по значениям экстинкции: для свекольного красителя бетанина при длине волны 540 нм, для каротиноидов из отходов переработки апельсинов — 440 и хлорофилла крапивы — 750 нм (табл. 20.4, 20.5).
Следует отметить, что образцы растворов красящих веществ, используемые в качестве контроля, в случае водной и спиртовой экстракции имели различную интенсивность, так как выход красящих веществ при экстракции спиртом был выше, чем с водной экстракцией, и составлял 230, 181 и 156% соответственно для свекловичных, апельсиновых отходов и крапивы.
Наибольший выход красящих веществ независимо от биохимического состава сырья и химической природы красителей наблюдался при водно-ферментативной обработке сырья с 0,1%-й концентрацией ферментных препаратов. Использование ферментных препаратов даже в малых количествах (0,01 %) для предобработки растительного сырья позволяет значительно увеличить выход красящих веществ (на 10—200 %).
Для получения свекольного красителя бетанина целесообразно использование Целловиридина, способного увеличивать выход пигмента до 260 и 191 % соответственно при водной и спиртовой экстракции; для получения каротиноидного красителя из отходов переработки апельсинов также предпочтителен Целловиридин, дающий увеличение выхода до 340 и 242 %; для хлорофиллового красителя из крапивы наилучший результат может быть получен при обработке сырья Лизофунгином, увеличивающим выход до 175 и 157 % соответственно.
Дата добавления: 2018-05-12; просмотров: 2690; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
