Определение растворимости труднорастворимой соли.
При установившемся равновесии в насыщенном растворе сильного малорастворимого электролита MA (МАтв=М++А-) соблюдается равенство химических потенциалов µ
 I.18
I.18
Левая часть равенства (I.18) при постоянной температуре - величина постоянная, следовательно, для насыщенного раствора можем записать:
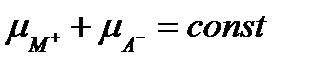 I.19
I.19
Выражая величины µ через активности получим
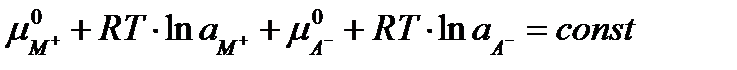 I.20,
I.20,
что можно переписать в виде:
 I.21
I.21
Величина Lа, постоянная при данной температуре, называется произведением активностей. Раствор малорастворимой соли является разбавленным растворам и, если такой раствор не содержит других веществ, влияющих на его ионную силу, то активности ионов можно заменить их молярными концентрациями:
 , I.22
, I.22
где L – произведение растворимости.
В растворе одно-одновалентного сильного электролита МА концентрации ионов одинаковы и, поэтому обозначив  =
=  как So, получим L=So2, или So=
как So, получим L=So2, или So=  , где So – растворимость малорастворимого электролита (моль/л).
, где So – растворимость малорастворимого электролита (моль/л).
Удельную электропроводность раствора труднорастворимой соли æр можно представить как сумму удельных электропроводностей соли æс и воды æв:
æр = æc + æв I.23
Соответственно для растворимости So можем записать (предполагая, что λс=λ∞, поскольку даже в насыщенном растворе соли ее концентрация очень мала) получим:
|
|
|
So = (æр - æв)*1000/λ∞ I.24
Зависимость растворимости от температуры может быть выражена уравнением
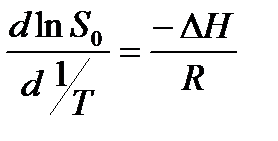 I.25,
I.25,
где ∆ H – дифференциальная теплота растворения. При расчете теплот растворения в узком интервале температур вместо уравнения (I.25) может быть использовано уравнение:
 I.26,
I.26,
поэтому дифференциальную теплоту растворения также можно определить графически по тангенсу угла наклона прямой в координатах (логарифм растворимости) – (1/T).
Изменение изобарного потенциала растворения при данной температуре можно рассчитать по формуле:
∆Go =-RT lnSo I.27,
что позволяет затем вычислить изменение энтропии растворения:
∆So = (∆ Ho - ∆ Go ) / T I.28
Работа 1.1. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИОННОЙ ЗАВИСИМОСТИ УДЕЛЬНОЙ И МОЛЯРНОЙ ЭЛЕКТРОПРОВОДНОСТИ СИЛЬНОГО ЭЛЕКТРОЛИТА
ЦЕЛЬ РАБОТЫ: экспериментальное определение зависимости удельной электропроводности водных растворов соляной кислоты от концентрации.
|
|
|
Оборудование: кондуктометр, ячейка, пипетка на 50 мл., химические стаканы.
Реактивы: HCl, дистиллированная вода.
Порядок выполнения работы:
1. Методом последовательного разбавления приготовить семь растворов соляной кислоты в интервале концентраций от 0,01 до 0,00015 М (0,01-0,005-0,0025- 0,0012-0,0006-0,0003-0,00015);
2. Измерить удельную электропроводность этих растворов, начиная с раствора с самой низкой концентрацией (при низких концентрациях при определении удельной электропроводности кислоты необходимо вводить поправку на электропроводность воды), при переходе от одного раствора к другому вылить первый раствор, ополоснуть ячейку дважды вторым раствором и затем проводить измерения;
3. Рассчитать молярную электропроводность изучаемых растворов;
4. Полученные результаты представить в виде таблицы:
Таблица 1.1
| Концентрация раствора C, моль/л | æ воды, См·см-1 | æ раствора, См·см-1 | l, см2См.моль-1 |
5. Представить результаты графически в координатах æ – C и l - С ½ ;
6. Экстраполяцией прямой в координатах l - С½ к С=0 определить предельную молярную электропроводность l ¥ соляной кислоты при температуре измерений и сравнить со справочной величиной;
|
|
|
7. Графически определить значение величины (Аэ + Врl ¥) в уравнении Онзагера, и сравнить с рассчитанной из уравнения (I.16).
Дата добавления: 2018-04-15; просмотров: 920; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
