ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
ТЕХНИКА БЕЗОПАСНОСТИ
При работе в лаборатории следует соблюдать следующие правила:
1. Каждый работающий в химической лаборатории должен иметь халат из хлопчатобумажной ткани.
2. Все электропроводящие части электроприборов должны быть исправны и заземлены. Нельзя касаться токоведущих частей электроприборов голыми руками. Включать электроприборы можно только на напряжение, указанное на приборе. Перед включением электроприбора следует проверить состояние проводки и контактов. При включении прибора вилка в розетку должна вставляться плотно, регуляторы напряжения перед включением и выключением прибора должны быть поставлены на ноль.
3. Запрещается устранять неисправности электрооборудования и подключать новые электроприборы без электрика. Необходимо помнить, что электрический ток силой 0,05 А уже опасен, а ток силой 0,1 А и выше – смертелен!
4. В лаборатории должна работать приточно-вытяжная вентиляция. В случае временного выключения вентиляции все работающие должны быть предупреждены; работы, связанные с выделением вредных паров и газов, необходимо прекратить.
5. При работе с концентрированными кислотами и щелочами следует надеть резиновые перчатки и защитные очки. При ожогах кислотами и щелочами надо промыть обожженное место проточной водой, а затем раствором бикарбоната натрия или борной кислоты, соответственно. При ожогах бромом или фенолом следует промыть пораженное место несколькими порциями спирта и смазать мазью от ожогов. В случае попадания паров брома или хлора в легкие следует подышать парами нашатырного спирта.
|
|
|
6. Легковоспламеняющиеся и горючие жидкости должны храниться в банках с притертыми пробками в металлических шкафах. Легковоспламеняющиеся жидкости (ЛВЖ) могут находиться на рабочем месте лишь в количествах, необходимых для работы. Все работы с ЛВЖ следует проводить в вытяжном шкафу при включенной вентиляции.
7. Все работы с ртутью можно проводить только на поддонах. В случае, если ртуть оказалась пролитой, следует немедленно прекратить работы и приступить к ее уборке. Демеркуризация помещения включает три обязательные процедуры: механическую очистку помещения от видимых шариков ртути, химическую обработку загрязненных поверхностей и влажную уборку. Обрабатываемую поверхность обильно смачивают 20 %-м водным раствором хлорида железа (III) и оставляют до полного высыхания. Через 1-2 суток поверхность тщательно промывают сначала мыльным раствором, затем чистой водой для удаления продуктов реакции и непрореагировавшей ртути.
8. При термических ожогах первой степени к обожженному участку кожи следует приложить тампон из ваты или марли, обильно смоченный спиртом. При тяжелых ожогах на пораженное место надо наложить стерильную повязку, а затем обратиться за врачебной помощью.
|
|
|
9. После окончания работы каждый проверяет отключение воды и электроэнергии на своем рабочем месте, а уходящий последним обязан проверить отключение воды и электроэнергии в лаборатории и в вытяжных шкафах.
10. В случае возгорания: а) ЛВЖ – необходимо в первую очередь выключить электроприбор и тушить пламя имеющимися в наличии противопожарными средствами (кошма, асбестовое одеяло, песок); б) электрических приборов – необходимо пользоваться углекислотными и порошковыми огнетушителями.
З А П Р Е Щ А Е Т С Я !
· Работать в химической лаборатории одному.
· Держать на лабораторных столах портфели, сумки и другие посторонние предметы.
· Принимать и хранить пищу, а также курить.
· Выливать в раковины какие-либо вещества (органические и неорганические). Их необходимо выливать только в специально отведенную химическую посуду, находящуюся под вытяжным шкафом.
· Нагревать летучие и огнеопасные жидкости на открытом огне. Нагревание их необходимо проводить только на водяной или песчаной бане или на закрытой плитке.
|
|
|
· Огнеопасные жидкости даже в небольшом количестве ставить вблизи нагревательных приборов.
· Засасывать вызывающие химические ожоги жидкости в пипетки без специальных приспособлений (груш).
· Выбрасывать ртуть в мусорные ящики и в канализацию.
ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Особое место среди растворов занимают растворы электролитов – веществ, которые в растворе или в расплаве распадаются на ионы – электрически заряженные частицы, способные к самостоятельному существованию в этих средах. Конденсированные ионные системы в виде растворов электролитов, их расплавов или твердых электролитов относятся к проводникам второго рода. Основные положения классической теории электролитической диссоциации в 1887 году были сформулированы С. Аррениусом.
Процесс спонтанного распада растворенного вещества на ионы называется электролитической диссоциацией. Физические причины, которые приводят к диссоциации электролитов, в теории Аррениуса не рассматривались. Вопрос о том, почему заряженные частицы (катионы и анионы) электростатически не взаимодействуют в растворе, также не обсуждался.
|
|
|
Несмотря на наличие ионов, раствор остается электронейтральным, т.к. сумма положительных зарядов равна сумме отрицательных зарядов. Количество ионов каждого знака определяется стехиометрическими коэффициентами в формуле электролита (HCl = H+ + Cl-, K2SO4 = 2K+ + SO42-).
Аррениусом было предположено, что диссоциация нейтральных молекул на ионы является неполной. Полнота диссоциации электролита количественно характеризуется степенью диссоциации a - отношением числа молекул, распавшихся на ионы (Nр ), к общему числу молекул этого электролита, введенных в раствор (Nо), т.е. a это доля распавшихся молекул, а (1-a) - доля молекул, оставшихся недиссоциированными:
a = Nр / Nо 1.1
Обычно a выражают в долях единицы или в процентах. Степень диссоциации электролита зависит от его химической природы, концентрации, температуры раствора, характера растворителя, присутствия в растворе одноименных ионов. По способности к диссоциации электролиты обычно разделяют на сильные и слабые. К сильным электролитам относят вещества, практически полностью диссоциирующие при растворении в воде. Обычно это соединения с ионным строением (практически все соли - NaCl, CH3COONa, CuCl2, минеральные кислоты - HCl, HNO3, HClO4 и др.). Слабые электролиты диссоциируют на ионы частично, например: вода, синильная кислота, сероводород, органические кислоты.
Аррениус предположил, что процесс электролитической диссоциации носит динамический характер и к нему применим закон действующих масс, а значит электролитическая диссоциация количественно характеризуется как степенью диссоциации, так и константой диссоциации. Например, если в растворе электролита HА с аналитической концентрацией С0 (мольная концентрация недиссоциированных молекул) и степенью диссоциации a диссоциация происходит по уравнению HА = H+ + А-, то равновесные концентрации молекул и ионов будут равны соответственно [МА ] = С0·((1 – a); [H+] = [А-] = a С0, и для константы электролитической диссоциации по теории Аррениуса Kc получается выражение:
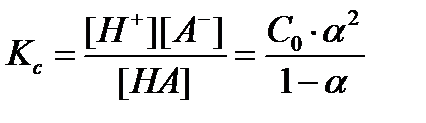 I.2
I.2
Уравнение (1.2) часто называется законом разведения Оствальда.
По теории Аррениуса константа Кс является постоянной для данного электролита, поэтому с помощью уравнения (2) можно рассчитать степень диссоциации электролита в зависимости от его концентрации. Из закона разведения следует. что чем больше Кс, тем выше степень диссоциации a., а значит величина Кс может служить мерой силы кислоты, т.е. мерой кислотности. Для очень слабого электролита a«1, тогда величиной a в знаменателе уравнения (1.2) можно пренебречь, и величину степени диссоциации можно получить из соотношения 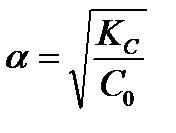 .
.
Строгая экспериментальная проверка уравнения (1.2) показала, что константа диссоциации Кс не остается постоянной, а изменяется при изменении концентрации любых электролитов, особенно сильных. (т.к. Аррениусовская константа диссоциации Кс является переменной величиной, то ее называют кажущейся константой диссоциации или функцией диссоциации). Этот недостаток теории Аррениуса связан с тем, что в ней ионы рассматривались как частицы идеального газа и игнорировались ион - ионные взаимодействия.
Учет ион-дипольного и ион-ионного взаимодействия сделан в теории П.Дебая и Хюккеля, где показано, что эти типы взаимодействий необходимо учитывать и при рассмотрении слабых электролитов. Поэтому для слабого электролита HA, диссоциирующего по уравнению HА = H + + А- ,закон действующих масс следует записать:
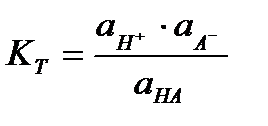 , I.3
, I.3
гдеKT - термодинамическая константа диссоциации, аi - активности i- частиц в растворе. Согласно теории Дебая – Хюккеля отличие активностей аi от концентрации Ci обусловлено только кулоновским взаимодействием, что было учтено введением коэффициентов активности fi, так что:
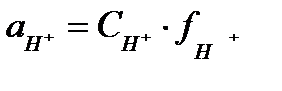 ;
; 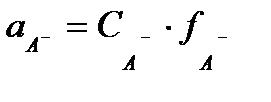 ;
; 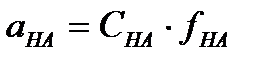 I.4
I.4
(если концентрации электролита выражаются в моляльной шкале, то используется коэффициент активности γi ).
С учетом выражения (1.4) можем записать соотношение между термодинамической константой диссоциации KT, величина которой неизменна при постоянной температуре, и кажущейся константой диссоциации Кс:
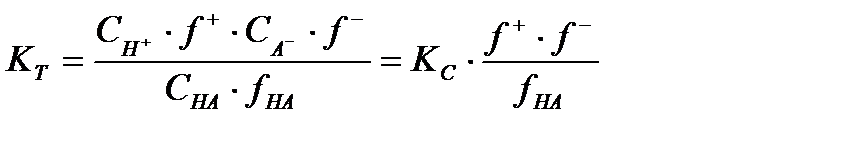 I.5
I.5
Согласно теории Дебая-Хюккеля отличие активности от концентрации обусловлено только кулоновским взаимодействием, поэтому для незаряженных частиц HА fHA = 1 и, следовательно получаем KT = Кс f + f - = Кс fi2. Для достаточно разбавленных растворов, к которым применима теория Дебая-Хюккеля и ионная сила ( I ) которых
I =1/2Σ (CiZi2)= 1/2 (α·С+ α·С ) = α·С ,согласно предельному закону Дебая-Хюккеля lgf± = -0,5 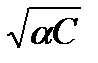 . В этом случае соотношение (1.5) легко преобразуется в уравнение
. В этом случае соотношение (1.5) легко преобразуется в уравнение
lgKc = lgKT + (С·a)1/2, I.6
представляющее собой уравнение прямой в координатах lgKc — (С·a)1/2, указывающей на линейное возрастание lgKc с ростом величины (С·a)1/2.
Увеличение кажущейся константы диссоциации Kc по мере возрастания концентрации слабого электролита подтверждено экспериментально. Подстановка активностей вместо концентраций необходима и при записи выражений для ионного произведения воды, произведения растворимости, констант ассоциации комплексных соединений и констант диссоциации амфолитов.
Дата добавления: 2018-04-15; просмотров: 395; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
