Возникновение потенциалов на границах фаз.
Известно, что при соприкосновении двух проводников, химически или физически разных, на поверхности их соприкосновения возникает скачок потенциала, величина которого не зависит ни от формы, ни от размеров проводников, а зависит от химической природы и физического состояния проводников. Гальваническая цепь состоит из соприкасающихся проводников первого рода (с электронным типом проводимости) и второго рода (с ионной проводимостью). На границах раздела фаз происходит пространственное разделение электрических зарядов за счет того, что на электроны и ионы действуют различные по величине химические силы. В результате разделения зарядов образуется двойной электрический слой и возникает разность электрических потенциалов между двумя проводниками, которая уравновешивает действие химических сил. Эта разность потенциалов (скачок потенциала) называется гальвани-потенциалом. Если из нескольких проводников I и II рода составить такую гальваническую (электрохимическую) цепь, чтобы на ее концах находились одинаковые по химическому составу металлы, то между концами такой правильно разомкнутой цепи возникает разность потенциалов Е, численно равная алгебраической сумме гальвани-потенциалов. Величина Е называется электродвижущей силой (ЭДС), являющейся важной количественной характеристикой цепи.
Система, в которой работа химических сил в окислительно-восстановительной реакции преобразуется в электрическую работу по перемещению заряда вдоль замкнутой цепи, называется гальваническимэлементом. Схема такого абстрактного элемента, состоящего из трех металлов М1, М2 и М3 и двух растворов электролитов L1 и L2, показана на рис.II.1. j L1 и j L2 – гальвани-потенциалы на границе раздела металл –раствор электролита, j D –скачок потенциала на границе раздела двух электролитов, j к – скачок потенциала на границе контакта металлов М1 и М3.
|
|
|

Рис. 2.1. Схема гальванического элемента
ЭДС гальванического элемента Е представляет собой разность потенциалов на концах разомкнутой цепи, когда во внешней цепи [a ……. b] отсутствует электрический ток. В этом случае система находится в состоянии равновесия, и ЭДС гальванического элемента численно равна максимально возможной работе по переносу единичного заряда вдоль замкнутой цепи.
Если же внешняя цепь замкнута [a ® b], то между точками a и b протекает ток за счет переноса электронов, а через границу раздела растворов электролитов CD (пористая перегородка) движутся переносящие заряд ионы. Протекание во внешней цепи электрического тока приводит к смещению равновесий на границах раздела металл – раствор электролита, поэтому система не является равновесной. В этом случае разность потенциалов между точками a и b меньше электродвижущей силы (т.е. меньше максимально возможной работы по переносу заряда).
|
|
|
Электродный потенциал
Рассмотрим более детально процесс возникновения скачка потенциала на границе раздела двух фаз. Структуру металла принято представлять в виде системы плотно упакованных сфер одинакового радиуса - положительных ионов. Атомы металла располагаются в кристаллической решетке на таком расстоянии, что их валентные электроны фактически связаны не с отдельным ядром, а делокализованы (обобщены) по всем атомам. Суммарный положительный заряд ионов равен числу электронов, и в обычном состоянии металл электронейтрален.
Растворение металла (переход катионов металла с поверхности электрода в водный раствор) объясняется гидратацией катионов. Ионы поверхности металла взаимодействуют с диполями воды, выделяющаяся при этом теплота гидратации идет на разрыв связи ионов с кристаллической решеткой металла. Способность катионов переходить в раствор выражена тем сильнее, чем меньше потенциал ионизации металла и чем больше его теплота гидратации. Например, литий имеет невысокий потенциал ионизации, а из-за малого радиуса ион Li + обладает сильным электрическим полем и энергично притягивает диполи воды, что сопровождается значительным выделением теплоты гидратации. Поэтому литий растворяется легче, чем металлы, расположенные правее лития в ряду напряжений металлов.
|
|
|
Когда гидратированные катионы металла переходят в раствор, поверхность электрода заряжается отрицательно из-за образующегося избытка электронов (рис. 2.2).
Электростатическое взаимодействие между отрицательно заряженным электродом и катионами металла в растворе вызывает обратный процесс - осаждение катионов металла из раствора на поверхности электрода. Процессы перехода катионов в раствор (окисление) и осаждения катионов металла из раствора на поверхности электрода (восстановление) идут одновременно, и со временем на поверхности раздела твердой и жидкой фаз устанавливается динамическое равновесие.
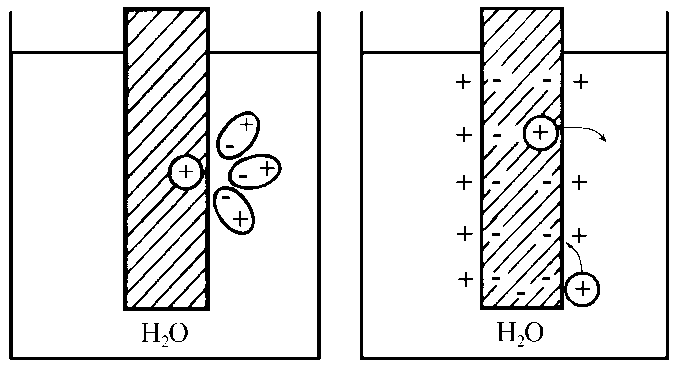
Рис.2.2. Возникновение скачка потенциала на границе
раздела металл - вода.
Катионы раствора вследствие электростатического взаимодействия с отрицательно заряженной поверхностью электрода ориентируются вблизи этой поверхности, образуя так называемый двойной электрический слой.
|
|
|
Межфазные переходы катионов происходят и в том случае, если металлический электрод поместить в раствор, содержащий одноименные катионы, например, в раствор соли этого металла (рис. 2.3). Знак заряда электрода зависит от соотношения скоростей процессов окисления и восстановления. Если до установления динамического равновесия скорость окисления металла выше скорости обратного процесса, то электрод заряжается отрицательно. Отношение скоростей окисления и восстановления зависит от соотношения значений химических потенциалов ионов металла в растворе и в металле, поэтому и величина заряда электрода определяется концентрацией катионов электролита в растворе.
Таким образом, на границе раздела двух фаз возникает разность потенциалов, величина которой зависит от природы контактирующих проводников.
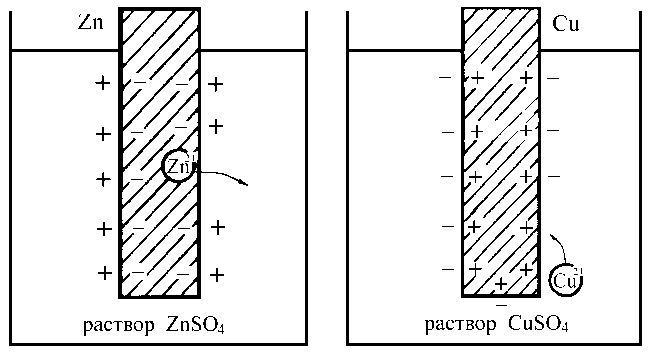
Рис. 2.3. Возникновение скачка потенциала на границе раздела
электрод - электролит (металл - раствор соли металла)
Величина скачка потенциала определяется полезной работой самопроизвольного процесса, протекающего на границе раздела фаз: затрата химической работы W′ компенсируется ростом скачка потенциала φ: - W′ = φ n F,
где W′ - максимальная полезная работа, которую совершает 1 моль металла при его переходе из одной фазы в другую; F - число Фарадея, численно равное произведению числа Авогадро на заряд электрона [Кл× моль-1]; n - число электронов, участвующих в элементарном электрохимическом процессе .
Прямое экспериментальное измерение отдельного гальвани-потенциала невозможно, поэтому было введено понятие электродного потенциала. Экспериментально измеряют электродвижущую силу гальванического элемента, составленного из двух электродов, причем исследуемый электрод записывают в схеме цепи справа, а электрод сравнения (например, водородный) – слева. ЭДС такого элемента, измеренную при установившихся электродных равновесиях, называют электродным потенциалом, или потенциалом "правого" электрода по отношению к "левому" электроду.
Электроды принято условно изображать схемой
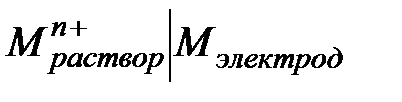 , предполагая, что на
, предполагая, что на
электроде слева направо протекает реакция восстановления (катионы двигаются из раствора к электроду)
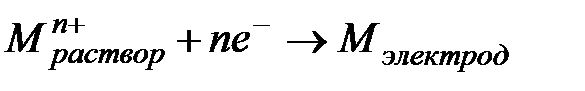 , 2.1
, 2.1
В этом случае электродный потенциал металла положителен.
Если же на электроде идет процесс окисления, то электродный потенциал такого металла будет отрицательным.
Выражение для электродного потенциала вытекает из зависимости изменения изобарно-изотермического потенциала DG для химической реакции от активности компонентов реакции. В явном виде зависимость электродного потенциала металла от его природы, активности катионов металла в растворе и температуры выражается уравнением Нернста, которое для электродной реакции (II-1)имеет вид:
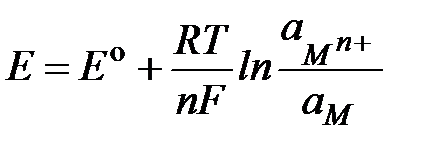 , 2.2
, 2.2
где 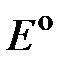 - стандартный электродный потенциал (равновесная разность потенциалов между металлом и раствором при активности катионов металла в растворе 1 моль × л-1); F - число Фарадея (96500 Кл × моль-1); R - универсальная газовая постоянная (8.31 Дж × моль-1град-1); n - число электронов, участвующих в электродной реакции;
- стандартный электродный потенциал (равновесная разность потенциалов между металлом и раствором при активности катионов металла в растворе 1 моль × л-1); F - число Фарадея (96500 Кл × моль-1); R - универсальная газовая постоянная (8.31 Дж × моль-1град-1); n - число электронов, участвующих в электродной реакции; 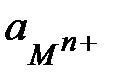 и
и 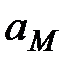 - активности окисленной (катионы металла в растворе) и восстановленной (атомы металла электрода) форм металла. Принимая активность металла в твердом состоянии равной единице и используя для разбавленных растворов концентрацию вместо активности, получим уравнение Нернста для электродного потенциала металла:
- активности окисленной (катионы металла в растворе) и восстановленной (атомы металла электрода) форм металла. Принимая активность металла в твердом состоянии равной единице и используя для разбавленных растворов концентрацию вместо активности, получим уравнение Нернста для электродного потенциала металла:
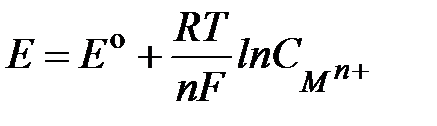 . 2.3
. 2.3
Водородный электрод
Водородный электрод (рис. 2.4) представляет собой электрод из платинированной платины (1), помещенный в раствор кислоты (2). Он омывается потоком газообразного водорода при давлении 101,3 кПа (» 1 атм). Водород в этой системе находится в трех состояниях: в молекулярной форме (Н2, газ), в атомарной (НPt на поверхности платины) и окисленной форме (ионы Н+ в растворе электролита). Молекулы водорода адсорбируются на поверхности электрода, диссоциируют на атомы, и непосредственно в электродном процессе участвуют адсорбированные на платине атомы водорода:
Н+(раствор) + e-==HPt,
2HPt == H2 (газ).
Суммарная электродная реакция
2Н+(раствор) + 2e- == H2 (газ)
протекает на поверхности платины с участием ее электронов. где Eo - стандартный потенциал водородного электрода; P - давление газообразного водорода; СН+ - концентрация Н+ в растворе.
|
| Количественно электродный потенциал такого электрода описывается уравнением Нернста, в котором концентрация восстановленной формы водорода выражена, в соответствии с законом Генри, через растворимость водорода в электролите(CH2= kPH2) :
|
Если концентрация ионов водорода в растворе 1моль× л-1, а давление газообразного водорода 1 атм, такой водородный электрод называется стандартным (нормальным). Стандартные электродные потенциалы металлических электродов, определенные по отношению к нормальному водородному электроду при 25оС, составляют ряд напряжений металлов.
Дата добавления: 2018-04-15; просмотров: 2013; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

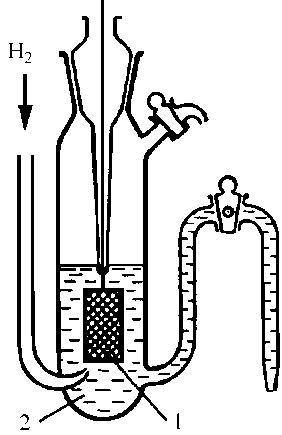 Рис. 2.4. Схема водородного электрода.
Рис. 2.4. Схема водородного электрода.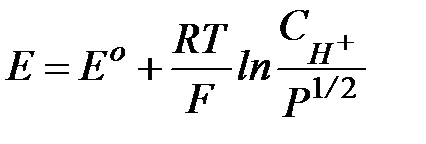 , 2.4
, 2.4