Температурная зависимость ЭДС.
К электрохимическим цепям, находящимся при постоянном давлении применимо уравнение Гиббса-Гельмгольца
 , 2.11
, 2.11
где ∆H-изменение энтальпии в ходе химической реакции.
Если ОВР(окислительно-восстановительная реакция) является итогом электродных процессов в электрохимической цепи и соответствует прохождению через цепь n электронов, то разделив все члены уравнения (II.9) на nF и поменяв знаки, с учетом соотношения  , получаем выражение
, получаем выражение  2.12
2.12
где величина  называется температурным коэффициентом ЭДС.
называется температурным коэффициентом ЭДС.
Так, как 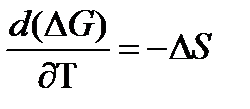 , то
, то  2.13
2.13
Таким образом, температурный коэффициент ЭДС характеризует изменение энтропии ∆S в ходе соответствующей химической реакции, а величина ∆ H характеризует общий тепловой эффект химической реакции при ее обратимом протекании в условиях постоянного давления. Гальванические элементы являются электрохимическими цепями с самопроизвольно протекающими химическими реакциями, для которых E > 0.
Если (dE/dT) < 0, то ОВР, протекающая в гальваническом элементе, может быть только экзотермической (∆H<0).Поскольку при протекании реакции энтропия уменьшается S<0 (см. 2.12), то работа гальванического элемента должна сопровождаться выделением теплоты. Следовательно, в условиях теплоизоляции электрохимическая система будет нагреваться. Таким образом, при работе гальванического элемента в условиях (dE/dT )<0 за счет убыли энтальпии совершается электрическая работа nFE и выделяется теплота в количестве nFТ(dE/dT).
|
|
|
Аналогичным образом можно показать, что если (dE/dT).>0, то при работе такого элемента будет происходить поглощение теплоты из окружающей среды. В случае теплоизоляции электрохимической цепи, она будет охлаждаться.
Если (dE/dT)=0, то реакция может быть только экзотермической. В этом случае ∆S=0 и работа гальванического элемента, совершаемая за счет убыли энтальпии, не должна сопровождаться тепловыми эффектами.
Электроды сравнения
Потенциометрические методы основаны на измерении электродных потенциалов, которые зависят от концентрации ионов в растворе. Поскольку измерить абсолютное значение электродного потенциала невозможно, на практике измеряют ЭДС цепи, составленной из двух электродов, т.е. разность потенциалов измерительного электрода и электрода сравнения, потенциал которого известен, практически постоянен и хорошо воспроизводится. Этим условиям удовлетворяют водородный, каломельный и хлорсеребряный электроды сравнения.
Водородный электрод сложен по конструкции, а его потенциал зависит от трудно контролируемых факторов. Его нельзя использовать для измерений в растворах, содержащих сильные окислители, которые отравляют платину. Поэтому на практике в качестве электродов сравнения применяют более простые электроды, потенциалы которых предварительно точно определены относительно стандартного водородного электрода.
|
|
|
Хлорсеребряный электрод
Хлорсеребряный электрод (рис. II.7) представляет собой серебряный электрод (1), часть поверхности которого электролитически покрыта слоем труднорастворимой соли AgCl (2). Он погружен в насыщенный раствор хлорида серебра AgCl в хлориде калия KCl (3). На границе раздела металл - раствор протекает окислительно-восстановительная реакция
AgCl + e- == Ag + Cl-.
|
Рис. 2.7. Хлорсеребряный электрод
| Потенциал такого электрода второго рода, согласно уравнению Нернста, определяется концентрацией катионов серебра в растворе:
где
|
Концентрацию ионов Ag+ определим из произведения растворимости L для AgCl:
LAgCl = CAg+ × CCl-, тогда  = L AgCl / C Cl-
= L AgCl / C Cl-
С учетом последнего выражения запишем уравнение (4.14) в виде:
 2.15
2.15
|
|
|
Поскольку величины  и
и  постоянны при данной температуре, последнее уравнение принимает вид:
постоянны при данной температуре, последнее уравнение принимает вид:
 2.16
2.16
где  - стандартный потенциал хлорсеребряного электрода. Из уравнения (II.16)следует, что потенциал хлорсеребряного электрода определяется концентрацией ионов Cl - в растворе. Потенциал хлорсеребряного электрода в насыщенном растворе KCl зависит только от температуры, он хорошо воспроизводится, и его величина относительно стандартного водородного электрода рассчитывается по формуле
- стандартный потенциал хлорсеребряного электрода. Из уравнения (II.16)следует, что потенциал хлорсеребряного электрода определяется концентрацией ионов Cl - в растворе. Потенциал хлорсеребряного электрода в насыщенном растворе KCl зависит только от температуры, он хорошо воспроизводится, и его величина относительно стандартного водородного электрода рассчитывается по формуле
ЕAgCl = 0.2224 - 0.00065 (t -25) [В]. 2.17
Если при измерении электродных потенциалов Ex в качестве стандарта используются разные электроды сравнения, например, хлорсеребряный и каломельный, то получают разные значения электродных потенциалов, отличающиеся друг от друга на значение разности потенциалов между различными электродами сравнения
(Ex =Eизм.- Eстанд.).
Дата добавления: 2018-04-15; просмотров: 3904; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


 , 2.14
, 2.14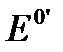 - стандартный электродный потенциал системы
- стандартный электродный потенциал системы  +/ Ag.
+/ Ag.