ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПОТЕНЦИАЛОВ
ЦЕЛЬ РАБОТЫ: Измерить редокс-потенциалы растворов различного состава, содержащих соли K3[Fe(CN)6] и K4[Fe(CN)6] и изучить зависимость величины редокс-потенциала этой системы от соотношения концентраций окисленной и восстановленной форм железа.
Оборудование: Штатив с бюретками, потенциометр (иономер), электроды платиновый (измерительный) и хлорсеребряный (сравнения), химические стаканы, фильтровальная бумага.
Реактивы: растворы красной K3[Fe(CN)6] и желтой K4[Fe(CN)6] кровяных солей одинаковой концентрации 0.01 моль×л-1, раствор KCl (2 моль×л-1), дистиллированная вода, бумажные фильтры.
Порядок выполнения работы:
1. Приготовить смеси растворов красной и желтой кровяных солей в соответствии с таблицей 4.
2. Собрать гальванический элемент
(-) Ag | AgCl, КClнасыщ || K3[Fe(CN)6], K4[Fe(CN)6] | Pt (+)
3. Включить иономер и подключить к нему платиновый и хлорсеребряный электроды.
4. Пользуясь бюретками отмерить в химический стакан объемы растворов красной и желтой кровяных солей в соотношении, указанном в табл. 2.4, добавить раствор KCl. Опустить в стакан электроды и измерить ЭДС гальванического элемента. Результаты записать в табл. 2.4.
5. Аналогичные измерения провести для всех других соотношений концентраций окисленной и восстановленной форм железа.
Таблица 2.4.
Влияние отношения Cох /Cred на величину редокс-потенциала Еr
| Объем, мл |
| lg (Cох /Cred ) | E, B | Er, B | ||
| K3[Fe(CN)6] | K4[Fe(CN)6] | КС1 | ||||
| 20 | 2 | 10 | ||||
| 16 | 6 | 10 | ||||
| 11 | 11 | 10 | ||||
| 6 | 16 | 10 | ||||
| 2 | 20 | 10 | ||||
6. Рассчитать величину редокс-потенциала Еr по формуле: Еr = E + ECl¯, Ag+/Ag,
|
|
|
где Еr - редокс-потенциал, В; Е - измеренное иономером значение ЭДС, В; ECl¯, Ag+/Ag - потенциал насыщенного хлорсеребряного электрода, величина которого для данной температуры рассчитывается по формуле:
ECl¯, Ag+/Ag = 0.2224 – 0.00065 (t – 25).
7. Построить график зависимости Еr от lg (Cox/Cгеd) - (линейные координаты уравнения Нернста). Рассчитать из графика тангенс угла наклона прямой и сравнить полученное значение с величиной RТ/nF = 0.059 в уравнении Нернста.
8. Графически определить величину стандартного редокс-потенциала Еоr. Объяснить расхождение полученной величины с ее табличным значением для этой системы.
Работа 2.5. ОПРЕДЕЛЕНИЕ рН И
БУФЕРНОЙ ЁМКОСТИ БУФЕРНЫХ СИСТЕМ
ЦЕЛЬ РАБОТЫ: Приготовление ацетатных буферных систем различного состава, измерение их рН и расчет буферной емкости.
Оборудование: Штатив с бюретками, стаканы 50 мл, потенциометр (рН-метр или иономер) с электродной системой (измерительный электрод - стеклянный, электрод сравнения - хлорсеребряный), фильтровальная бумага.
|
|
|
Реактивы: Растворы CH3COOH (0.1 М), CH3COONa (0.1 М), HCl (0.1 М), NaOH (0.1 М)).
Порядок выполнения работы:
1. Приготовить смеси растворов CH3COOH и CH3COONa в соответствии с табл. II.4. Измерить рН этих смесей, записать результаты в строке рН1.
2. Рассчитать значения рНрасчетн. буферных смесей разного состава по уравнению (2.18) и сравнить с измеренными величинами рН1.
3. В строке рН2 табл. 5, записать результаты измерений рН2 после каждого добавления к 20 мл раствора буферной системы состава №1 сильной кислоты и щелочи в соответствии с табл.2.5.
4. Рассчитать значения буферной емкости приготовленных смесей.
5. Написать уравнения химических реакций, протекающих при добавлении к ацетатной буферной системе сильной кислоты и щелочи.
Таблица 2.5.
Зависимость величины буферной емкости системы β от изменения рН
| № | Объем раствора, Мл | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1 | CH3COONa | 10 | 18 | 16 | 14 | 12 | 2 | 4 | 6 | 8 |
| 2 | CH3COOH | 10 | 2 | 4 | 6 | 8 | 18 | 16 | 14 | 12 |
| 3 | рН1 | |||||||||
| 4 | добавление | |||||||||
| к раствору 1 | ||||||||||
| HCl | 1 | 2 | 3 | 4 | 5 | - | - | - | - | |
| NaOH | - | - | - | - | - | 1 | 2 | 3 | 4 | |
| 5 | рН2 | |||||||||
| 6 | рН2 (расчетн.) | |||||||||
| 7 | Буф. емкость β |
|
|
|
6. Построить графическую зависимость величины β от рН буферного раствора.
Работа 2.6. РАСЧЕТ ТЕРМОДИНАМИЧЕСКИХ ВЕЛИЧИН ДЛЯ ОВР ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА НА ОСНОВЕ СПРАВОЧНЫХ ДАННЫХ ПО ЭДС И ЕЁ ТЕМПЕРАТУРНОМУ КОЭФФИЦИЕНТУ ДЛЯ ЭТОГО ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
ЦЕЛЬ РАБОТЫ: рассчитать стандартные величины ∆G0, ∆H0, ∆S0 для ОВР, протекающих в гальваническом элементе.
Порядок выполнения работы:
1. Получить у преподавателя задание.
2. Написать уравнение ОВР для выбранного гальванического элемента.
3. Найти в справочнике значения ЭДС и температурного
коэффициента ЭДС, записать в табл.II.6
4. Рассчитать ∆G0, ∆H0, ∆S0 с использованием формул II.12-II.13.
Таблица 2.6.
Результаты расчета термодинамических характеристик ОВР, протекающей в гальваническом элементе____________________
Т= 0К.
| Способ расчета | Е | dE/dT | ∆S0 | ∆G0 | ∆H0 |
| По величинам Е и dE/dT | |||||
| по ∆G0 и ∆H0 образ. |
|
|
|
5. Сравнить полученные значения ∆G0, ∆H0, ∆S0 для ОВР с этими же характеристиками, рассчитанными из справочных данных по ∆G0 и ∆H0 образования участников ОВР.
КОНТРОЛЬНЫЕ ВОПРОСЫ
Перед выполнением работы:
1. Механизм возникновения скачка потенциала на границе раздела металл - раствор его соли.
2. Что называется гальвани-потенциалом, электродным потенциалом, стандартным электродным потенциалом?
3. Что называется гальваническим элементом и каково его устройство? Как определяются катод и анод?
4. Почему для измерения истинной величины ЭДС гальванического элемента применяют компенсационный метод, нарисуйте схему измерения компенсационным методом.
5. Какие электроды используют в качестве электродов сравнения?
6. От каких параметров зависит ЭДС концентрационного элемента?
7. Привести примеры окислительно-восстановительных систем; написать уравнения электрохимических реакций. Зависит ли потенциал редокс-электрода от температуры?
8. Поясните устройство стеклянного электрода и напишите для него токообразующую реакцию.
9. Приведите примеры буферных систем и их основные свойства.
10. Пояснить порядок выполнения всех лабораторных работ 2.1 → 2.6.
К защите работы:
1. Показать, какие скачки потенциалов возникают на границах раздела фаз в медно-цинковом гальваническом элементе. Какие из них дают максимальный вклад в величину ЭДС элемента?
2. Приведите примеры концентрационных цепей и запишите для них уравнение Нернста.
3. Показать механизм буферного действия ацетатной буферной системы при добавлении к ней раствора соляной кислоты. Как изменится рН после добавления HCl?
4. Поясните, в каких случаях теплоизолированный гальванический элемент может нагреваться (или охлаждаться) во время работы.
5. Чем вызвано использование разных электродов сравнения? Приведите примеры.
6. Какие типы электродов вы знаете? Для каждого из типов электродов вы знаете? Для каждого из типов электродов напишите электродную реакцию и уравнение Нернста.
АДСОРБЦИЯ
Состояние молекул, атомов или ионов на границе раздела фаз в поверхностном слое жидкости или твердого тела отличается от состояния частиц, находящихся в объеме.
В глубине жидкости или твердого тела частица окружена со всех сторон такими же частицами, воздействие которых друг на друга взаимно компенсируется. Частицы на поверхности раздела двух фаз не имеют слоя одноименных частиц над ними, поэтому силы их взаимодействия с соседями не является полностью скомпенсированным, как это имеет место в глубинных слоях. Поэтому частицы поверхностного слоя обладают некоторой избыточной потенциальной энергией, так называемым силовым полем, которое взаимодействует с частицами сосуществующей фазы. В результате такого взаимодействия происходит самопроизвольное поглощение частиц сосуществующей фазы поверхностью раздела. Это явление называется адсорбцией.
|
|
Рис.3.1.
|
Вещество, поглощаемое поверхностью раздела называют адсорбатом, а твердая фаза или жидкость, образующие поверхность раздела, называют адсорбентом.
Различают физическую адсорбцию и химическую адсорбцию (хемосорбцию). Они различаются природой сил, действующих между адсорбатом и адсорбентом.
При физической адсорбции действуют силы межмолекулярного взаимодействия, главными из которых являются силы Ван-дер-Ваальса, а также другие силы физической природы: силы взаимодействия постоянных или индуцированных диполей и квадруполей. Действие всех этих сил является слабым, и время пребывания частиц на поверхности мало, что не приводит к изменению химической природы адсорбата и адсорбента.
При хемосорбции имеет место химическое взаимодействие между частицами адсорбата и адсорбента за счет большей, чем при физической адсорбции энергии взаимодействия, при этом происходит перераспределение электронов между сосуществующими фазами, в результате чего на поверхности образуется новое химическое соединение, например, оксид металла при контакте кислорода с металлической поверхностью.
Имеется ряд критериев, совокупность которых (теплота адсорбции, температурная зависимость, температурная область протекания и др.), позволяет определить характер адсорбции.
Косвенным критерием определения типа адсорбции является значение теплота адсорбции Q, то есть теплоты. Выделяющейся в процессе адсорбции и отнесенной к одному молю адсорбата. Если Q < 30-40 кДж/моль, говорят о физической адсорбции, при Q > 40 кДж/моль – о хемосорбции. Концентрирование вещества в поверхностном слое идет самопроизвольно, процесс характеризуется отрицательным значением ΔG, при этом изменение энтропии при физической адсорбции всегда отрицательно, а при хемосорбции, в принципе, может быть и положительным. Поэтому энтальпия физической адсорбции всегда отрицательна, а при хемосорбции, в некоторых случаях, бывает и положительной величиной. Для более четкого разграничения типов адсорбции необходимо сравнивать ряд других физико-химических характеристик этих процессов, например энергии активации и скорости сорбции и десорбции.
При контакте адсорбата и адсорбента в системе устанавливается динамическое адсорбционное равновесие при котором скорость адсорбции равняется скорости обратного процесса – десорбции. Например, N2 + A = N2A, где A – поверхность адсорбента, N2A – адсорбированная на поверхности молекула азота.
Зависимость величины адсорбции (количество адсорбированного вещества, выраженное в молях или граммах) от равновесного давления или равновесной концентрации адсорбата при постоянной температуре называется изотермой адсорбции. Величина адсорбции и форма изотерм зависит от ряда факторов, таких как природы адсорбата и адсорбента, температуры, характера поверхности адсорбента и др.

Рис. 3.2.Типы изотерм адсобции: 1- изотерма Генри, 2- изотерма Лэнгмюра, 3- изотерма БЭТ
Уравнения Генри, Лэнгмюра, БЭТ и др. описывают разные модели адсорбции. Соответствующие этим моделям типы изотерм адсорбции представлены на рисунке 2.
В настоящее время при описании адсорбции используют два основных подхода – метод абсолютных концентраций (или полного содержания) и метод избыточной адсорбции Гиббса. Выбор того или иного подхода обусловлен природой изучаемой системы. При рассмотрении адсорбции на твердых адсорбентах обычно используют метод полного содержания, так как количество адсорбированного вещества можно определить экспериментально. Для жидкой поверхности раздела непосредственно измеряют межфазное поверхностное натяжение, и для расчетов адсорбции используют метод Гиббса.
Метод полных концентраций
В методе абсолютных концентраций поверхностный слой и объемная фаза рассматриваются как две равновесные фазы. Основной характеристикой процесса является количество адсорбата, приходящееся на единицу поверхности или массы адсорбента. Наиболее просто описывается монослойная локализованная адсорбция на однородной поверхности. Используя следующие допущения:
- поверхность адсорбента однородна, все центры энергетически эквивалентны;
- в результате адсорбции образуется мономолекулярный слой;
- отсутствует взаимодействие между соседними адсорбированными частицами,
- адсорбированные молекулы неподвижны (локализованная адсорбция),
Лэнгмюр вывел уравнение изотермы адсорбции:
 3.1
3.1
или
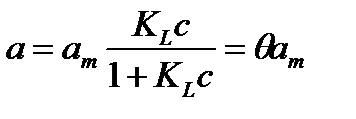 3.2
3.2
где a – адсорбция, р – равновесное давление (или с - равновесная концентрация), аm – предельная монослойная адсорбция, KL – константа адсорбционного равновесия, характеризующая энергию взаимодействия адсорбат – адсорбент, Θ – степень заполнения поверхности адсорбатом.
Если с<<1, то уравнение Лэнгмюра переходит в уравнение изотермы адсорбции Генри:
 3.3
3.3
где КГ – константа Генри.
Если с>>1, то 
Если поверхность неоднородна, используют эмпирическое уравнение Фрейндлиха:
 3.4
3.4
где х – количество адсорбированного вещества, m – масса адсорбента, k, k1, k2, n – некоторые варьируемые параметры.
Учет взаимодействия между молекулами адсорбата и возможности их перемещения по поверхности адсорбента приводит к изотерме адсорбции Хилла-де-Бура:
 3.5
3.5
где К1 – константа адсорбционного равновесия, К2 – характеризует взаимодействие между адсорбированными молекулами.
При многослойной адсорбции изотерма описывается уравнением Брунауэра – Эммета – Теллера (БЭТ):
 3.6
3.6
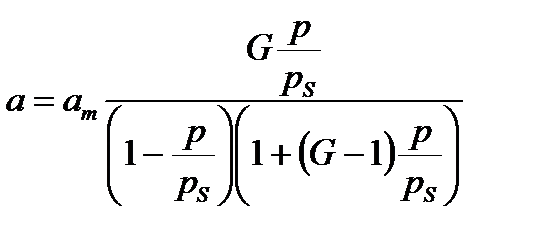 3.7
3.7
где ps – давление насыщенного пара адсорбата, G – постоянная, численно равная отношению константы адсорбционного равновесия к константе конденсации, обратно пропорциональной ps.
Для определения значений предельной монослойной адсорбции и константы адсорбционного равновесия проводят линеаризацию уравнений (3.1)-(3.7) и в соответствующих координатах строят графики (рис.3).
| | Рис.3.3. Линеаризация уравнения Лэнгмюра.
|
Например, линейный вид изотермы Лэнгмюра и изотермы БЭТ:
 3.8
3.8
 3.9
3.9
Из уравнений (3.8) и (3.9) легко определить предельную монослойную адсорбцию am, а зная am можно рассчитать площадь поверхность адсорбента S, если известна площадь, занятая одной молекулой адсорбата ω:
Sуд = am ω NA 3.10
Дата добавления: 2018-04-15; просмотров: 703; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!



