Адсорбция из жидких растворов на поверхности твердых адсорбентов
Рассмотрим раствор, состоящий из двух компонентов (светлые и темные кружки), находящийся в соприкосновении с поверхностью твердой фазой (затемненная часть рисунка). В системе сравнения 1 адсорбционные силы отсутствуют. Один из компонентов, который в большей степени концентрируется на поверхности твердой фазы в реальной системе 2, будем считать адсорбатом (темные кружки), а другой – растворителем (светлые кружки).
Уравнение Гиббса для такой системыможно записать, как
 ,
,
где индексы 1 и 2 соответствуют компонентам жидкого раствора, а индекс 3 - твердому адсорбенту. Если компоненты 1 и 2 не растворимы в твердой фазе 3, то dμ3 = 0 и
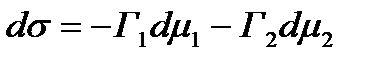 3.19
3.19
Следует отметить, что поверхностное натяжение твердой поверхности при адсорбции изменяется, но это изменение очень трудно измерить ввиду слишком малой его величины.
Адсорбцию, выраженную в молях, молекулах, граммах и др. на единице поверхности адсорбента можно представить в виде абсолютного количества i –го вещества (полного содержания вещества) (ai) в адсорбционном слое или в виде избыточного количества i –го вещества Гi (по Гиббсу), которым обладала бы реальная гетерогенная система по сравнению с системой сравнения, отнесенное к площади поверхности раздела фаз.

Рис. 3.6. Адсорбция на поверхности твердого адсорбента: 1-система сравнения, 2-реальная система, t-толщина адсорбционного слоя
|
|
|
Сравним распределение молекул адсорбата (темные кружки на рис. 6) в реальной системе 2 и в системе 1 после установления в них адсорбционного равновесия. В гипотетической системе 1 имеет место равномерное распределение разноименных молекул по объему, тогда как в реальной системе 2 действие адсорбционных сил приводит к концентрированию избыточного по сравнению с системой 1 количества молекул адсорбата (темные кружки) в адсорбционном слое толщиной ţ. Тогда величину адсорбции Гиббса для единицы поверхности, как избыток Гi, можно записать:
 3.20
3.20
Здесь аi – содержание адсорбата в адсорбционном слое ţ реальной системы;
ţСi – содержание адсорбата в адсорбционном слое ţ системы сравнения.
Для модели, представленной на рисунке 6,
Гi = 9 – 6 = 3
Экспериментально адсорбция измеряется как избыточное количество вещества. Для твердых адсорбентов величина адсорбции i –го компонента определяется по формуле:
 3.21
3.21
где nsi – поверхностный избыток i – го компонента адсорбата,
|
|
|
A – площадь поверхности адсорбента,
V – объем исследуемого раствора,
Ci0 – исходная концентрация i – го компонента раствора,
Ci – равновесная концентрация раствора,
ma - навеска адсорбента,
Sуд – удельная поверхность адсорбента.
При известном объеме адсорбционного слоя Va можно перейти от адсорбции, выраженной как избыток, к абсолютному количеству адсорбированного вещества по уравнению:
 3.22
3.22
Здесь VaСi – количество i – го компонента адсорбата, которое содержится в адсорбционном слое толщиной ţ в системе сравнения.
Особенностью адсорбции из растворов является взаимное вытеснение компонентов из адсорбционного слоя при изменении состава исходного раствора, что связано с наличием сил межмолекулярного взаимодействия одноименных и разноименных молекул или атомов, а также с конкуренцией этих частиц за поверхность адсорбента.
При адсорбции из растворов двух веществ, неограниченно взаимно растворимых, избыточная адсорбция наблюдается только в монослое (ţ равно диаметру молекулы). При большой разнице в энергиях взаимодействия частиц адсорбата и растворителя с адсорбентом адсорбат при определенной концентрации может полностью вытеснить молекулы растворителя из адсорбционного слоя. В этом случае полное содержание адсорбата достигнет своего предельного значения аi, равного величине монослоя. Таким образом, зависимость nsi от концентрации проходит через максимум и при дальнейшем увеличении концентрации адсорбата в растворе линейно уменьшается до нуля для чистого адсорбата.
|
|
|

Рис.3.7. Изотермы адсорбции растворов двух неограниченно взаимно растворимых жидкостей
Изотермы адсорбции, как избытка (nsi) и как абсолютного количества (а) для растворов двух неограниченно взаимно растворимых жидкостей показаны на рис.7. Экстраполяция линейного участка изотермы гиббсовской адсорбции к нулевому значению концентрации отсекает на оси nsi величину емкости монослоя am (уравнение 22).
На практике адсорбционные измерения используют для определения удельной поверхности адсорбента Sуд.. Для этого в качестве адсорбата берут молекулы с известной посадочной площадкой (площадью ω, занимаемой молекулой на поверхности в адсорбированном состоянии в плотном монослое). Экспериментально определяют емкость монослоя am в молях на грамм адсорбента, которую используют для расчета удельной поверхности адсорбента по формуле:
|
|
|
Sуд = am ω NA 3.23
NA–число Авогадро.
Для растворов ограниченно взаимно растворимых жидкостей получаются S – образные изотермы за счет расслоения адсорбированного раствора и увеличения Va так же как и для полимолекулярной адсорбции паров на твердом адсорбенте.
Теплоты адсорбции
Изотермой адсорбции называют зависимость величины адсорбции от равновесного давления (Г = f(P)) или от равновесной концентрации (Г = f(С)) адсорбата. Изотермы адсорбции в явной или в скрытой форме содержат практически всю информацию об адсорбционной системе, в том числе и о теплотах адсорбции. Теплотой адсорбции в общем виде называется количество теплоты, выделяемое при адсорбции. Для удобства сравнения теплоты адсорбции относят к единице количества адсорбата. Различают изостерическую (дифференциальную) и интегральную теплоты адсорбции.
Изостерической теплотой адсорбции называется теплота, которая выделилась бы при изотермическом переносе при постоянном давлении бесконечно малого количества вещества из газовой фазы в адсорбционную в состоянии равновесия при данной степени заполнения (Г = const) в расчете на 1 моль адсорбата:
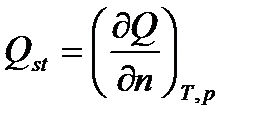
Она определяется формулой:
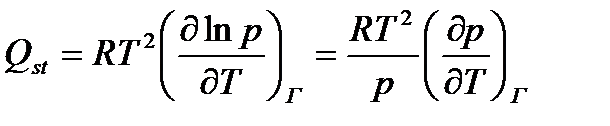 3.24
3.24
и рассчитываетсяэкспериментально из изостер адсорбции (из зависимостей вида P = f(T) при Г = const) методом графического дифференцирования изостер, изображенных на рисунке 8b.
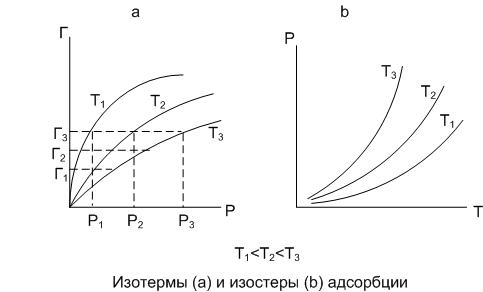
Рис.3.8. Изотермы (а) и изостеры (б) адсорбции
при Т1<Т2<Т3
Чаще используется другой более удобный метод определения Qst. Полученные экспериментально изотермы адсорбции при нескольких температурах (как минимум трех) наносят на один график и делят серией (как минимум из пяти) прямых, соответствующих разным значениям адсорбции, как показано на рисунке 8, что соответствует разным степеням заполнения. Абсциссы точек пересечения каждой из этих прямых Г1,Г2,Г3… Гi с изотермами дает значения равновесных давлений Р1, Р2, Р3, Р4 соответствующее температурам Т1, Т2, Т3 и Т4 при определенной степени заполнения поверхности адсорбента. Полученные таким способом значения параметров для выбранных значений адсорбции Гi заносят в таблицу 3.1.
Приняв, что изостерическая теплота адсорбции Qst. не зависит от температуры, что допустимо в узком интервале температур, уравнение (14) интегрируют, и представляют в виде:
 3.25
3.25
Таблица 3.1
| Т1 | Т2 | Т3 | Т4 | 1/ Т1 | 1/ Т2 | 1/ Т3 | 1/ Т4 | Qst | |
| Г1 = | |||||||||
| Р lnP |
|
| |||||||
|
| |||||||||
| Г2 = | |||||||||
| Р lnP |
|
| |||||||
|
| |||||||||
По экспериментальным данным (таблица 3.1) значениям строят график зависимости lnP от 1/T для каждой степени заполнения (для каждого значения Гi), как показано на рисунке 9а. Тангенс угла наклона каждой прямой к оси абсцисс позволяет нам определить изостерическую теплоту адсорбции при данной степени заполнения.
В случае адсорбции паров при больших парциальных давлениях наблюдается полимолекулярная адсорбция и затем конденсация.
Начальные участки представленных на рисунке 8b в качестве примера кривых 1, 2 и 3 (область мономолекулярной адсорбции) зависимости изостерической теплоты адсорбции от степени заполнения позволяют сделать вывод о типе поверхности адсорбента и о характере поведении частиц адсорбата на границе раздела фаз, что дано в описании рисунка 3.9. Интегрируя изостерическую теплоту адсорбции (Qst. – дифференциальная величина) по количеству адсорбата, в пределах от 0 до Го, можно оценить среднемольную (интегральную) теплоту адсорбции Q, отнесенную к молю адсорбата, по уравнению:
 3.26
3.26
Го – максимальное количество адсорбированного вещества. На графике (рис. 9b) величине интеграла в указанных пределах соответствует затушеванная площадь с учетом масштаба по соответствующим осям.

Рис. 3.9.
а) Изостеры адсорбции в координатах уравнения (3.15), где 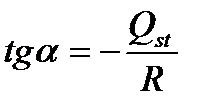 ;
;
б) Зависимости изостерической теплоты адсорбции от количества адсорбированного вещества для разных поверхностей:
1 - однородная поверхность в отсутствие взаимодействия адсорбат – адсорбат;
2 – однородная поверхность при взаимодействии между молекулами адсорбата;
3 – неоднородная поверхность.
Qконд – теплота конденсации
Дата добавления: 2018-04-15; просмотров: 581; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
