Теория взаимозаменяемости антибиотиков
В настоящее время есть 4 группы антибиотиков широкого спектрадействия (β-лактамы, аминогликозиды, фторхинолоны тетрациклины). Еслипопробовать запретить применение одной группы (например, группы №1)антибиотиков, то резистентность к ним исчезает через 10 лет. Послевозобновления применения 1-ой группы, запрещают применение 2-ой группыи т.д.
Но сейчас нельзя исключить ни одной группы антибиотиков из практикилечения, так как достаточно активных и безопасных антибиотиков еще нехватает и требуется создавать новые и новые группы, но, со временем,наверное, можно применить такую схему чередования разных группантибиотиков для повышения терапевтического эффекта.
Известно, что в разных частях бактериальной клетки транспептидазапептидогликана как белок неодинакова, с другой стороны, всемногочисленные антибиотики имеют одинаковый механизм действия напатогенный микроорганизм, поэтому в рекомендациях по применениюантибиотиков различного характера имеется информация повзаимодействию их с пенициллинсвязывающими белками (ПБС). Этарекомендация связана с иммунитетом человека, принимающегоантибиотики. Если есть информация в рекомендациях по применению, чтоновый антибиотик связывается с ПБС-2, то это означает, что клеткамикроорганизма будет активно лизироваться и освобождающиесяполисахариды в большом количестве будут поступать в кровь, что в своюочередь работает как пирогенный фактор и ведет к повышениютемпературы больного на короткое время. Такие антибиотики могут бытьрекомендованы больным с невысоким уровнем иммунитета (например, этобольные СПИДом). Если же есть информация о ПБС-3, то это означает,что в результате действия такого антибиотика бактериальная клеткатолько временно перестает делиться, оставаясь живой и после отменыэтого антибиотика, она начинает снова свое размножение с большойактивностью и с опасностью возникновения новой инфекции. Для людей снизким иммунитетом применение таких антибиотиков опасно. Реализуя впродаже тот или иной антибиотик, вы должны предупреждать врачей отаком факте.
|
|
|
Широкое и успешное использование антибиотиков в медицинепривело к их использованию и в других областях, в том числе:
– в ветеринарии (с теми же целями, что и в медицине);
– для борьбы с некоторыми болезнями растений бактериального игрибкового происхождения;
– в качестве добавки к кормам животных, так как они ускоряютрост и увеличивают степень превращения кормов в мясо;
– в качестве консервантов скоропортящихся продуктов;
– для подавления бактериальной флоры при осуществлении различных процессов при производстве вакцин.
|
|
|
Наука об антибиотиках продолжает быстро развиваться. С однойстороны, продолжаются поиски новых, еще более эффективных препаратов биотехнологии, в том числе с иммуностимулирующим, противоопухолевым, противовирусным действием, с другой стороны, расширяются работы по химическому синтезу производных этих веществ и химической модификации природных антибиотиков.
Список использованной литературы:
1. Биотехнология. Ю.О. Сазыкин, С.Н. Орехов, И.И. Чакалева – М.: «Академия», 2007 г. – 215 с.
2. Егорова Т. А. Основы биотехнологии: Учеб. пособие для высш. пед. учеб заведений / Т.А.Егорова, С.М.Клунова, Е.А.Живухина. — М.: Издательский центр «Академия», 2003. — 208 с.
3. Катлинский А.В., Сазыкин Ю.О., Орехов С.Н., Чакалева И.И., Курс лекций по биотехнологии / ММА им. И.М. Сеченова, 2005 г. – 150 с.
4. Османов В.К., Лекции по биотехнологии/Ниж ГМА, 2008 г. – 250 с.
5. Основы фармацевтической биотехнологии, Т.П. Прищеп, В.С. Чучалин, К.Л. Зайков, Л.К. Михалева, Л.С. Белова – Ростов н/Д.: Феникс, 2006 г. – 180 с.
6. Тимощенко Л.В., Чубик М. В. Основы микробиологии и биотехнологии: учебное пособие /Л.В. Тимощенко, М.В. Чубик. – Томск: Изд-во Томского политехнического университета, 2009. – 194 с.
7. Фармацевтическая биотехнология: учеб. пособие / В.А. Быков (и другие) под общ. редакцией акад. РАМН и РАСНХ, профессора В.А. Быкова – Воронеж: издательство Воронеж. гос. ун-та, 2009. – 439 с.
|
|
|
Интернет ресурсы:
8. www.biotechnolog.ru
9. Биотехнология: генная инженерия, промышленная биотехнология, клеточная инженерия – учебное пособие: [электронный ресурс]. – Режим доступа: http://www. biotechnolog.ru
10. Биоинформатика, геномика, протеомика. биософт, имейджинг: [Электронный ресурс]. – Режим доступа: http://www.bioinFormatix.ru
11. Интернет журнал «Коммерческая биотехнология»: [Электронный ресурс]. – Режим доступа: http://www.cbio.ru
12. Общество биотехнологов России им. Ю.А. Овчинникова: [Электронный ресурс]. – Режим доступа: http://www.biorosinfo.ru Remedium.ru:
13. Профессионально о медицине и фармации [Электронный ресурс]. – Режим доступа: http://www.remedium.ru
14. Новости GMP – Стандарт GMP – Фармацевтические производства и технологии [Электронный ресурс]. – Режим доступа http://www.gmpnews.ru
15. Ассоциация Российских фармацевтических производителей [Электронный ресурс]. – Режим доступа http://www.arfp.ru
Федеральное государственное бюджетное образовательное учреждение высшего образования «Северо-Осетинская государственная медицинская академия» Министерства здравоохранения Российской Федерации
|
|
|
Лекция №8
Тема лекции:Ферментные препараты и иммобилизация ферментов.
Ф.И.О. ассистента: Караева А.М.
по предметубиотехнология
факультет фармация
курс IV, VIII семестр
Лекция №8
Тема лекции:Ферментные препараты и иммобилизация ферментов.
Цель лекции:ознакомить студентов с использованием ферментных препаратов в медицине. Изучить понятие иммобилизации, методы иммобилизации ферментов, микроорганизмов, животных и растительных клеток, а также преимущества иммобилизации и применение при создании лекарственных средств.
План лекции:
1. Ферменты
2. Применение ферментов
3. Источники ферментов
4. Технология культивирования микроорганизмов - продуцентов ферментов
4.1 Технология выделения и очистки ферментных препаратов
5. Инженерная энзимология, ее задачи
6. Иммобилизованные ферменты
6.1. Носители для иммобилизации ферментов
6.2. Методы иммобилизации ферментов
6.3. Иммобилизация клеток
6.4. Промышленные процессы с использованием иммобилизованных ферментов и клеток
6.5. Биосенсоры на основе иммобилизованных ферментов
6.6. Иммобилизованные ферменты в медицине
Оснащение лекции: презентация
Место проведения: аудитория 525
Ферменты
В основе современной инженерной энзимологии лежит применение иммобилизованных ферментов и ферментных систем. Вспомним природу самих ферментов.
Ферменты – это катализаторы биологического происхождения. Наиболее ценные свойства ферментов – это высокая активность и специфичность (селективность) действия. Живые организмы содержат сотни и тысячи ферментов, основная функция которых заключается в регуляции практически всех химических реакций, определяющих жизнедеятельность организма.
Приведем классификацию ферментативных реакций.
Это:
1. окисление и восстановление
2. перенос функциональных групп от одних молекул на другие
3. гидролиз
4. реакции с участием двойных связей
5. изомеризация, или структурные изменения в пределах одной молекулы
6. синтез сложных соединений (обычно с энергетическими затратами).
У ферментов сложное пространственное строение, включающее определенную комбинацию химических групп. Имеются сведения, что в природе обнаружено свыше трех тысяч разных специфических ферментов.
Однако, технологическое применение ферментов имеет ограничения по следующим причинам:
1. большая затрата труда на отделение от исходных агентов (как правило ферменты используются однократно)
2. неустойчивость (лабильность ферментов при хранении)
3. большая затрата труда на очистку ферментов, что определяет высокую стоимость их производства.
Сравнительно недавно (несколько десятков лет назад) четко определились пути преодоления этих трудностей. Эти пути связаны с получением иммобилизованных ферментов и иммобилизованных клеток микроорганизмов.
2. Применение ферментов
Ферменты сохраняют свои уникальные свойства (эффективность, специфичность действия) вне клеток, поэтому их традиционно широко применяют в практике. Биологические катализаторы нетоксичны, работают в мягких условиях, используют доступное сырье (в том числе и отходы), в связи, с чем их применение в промышленности выгодно с экономической и экологической точек зрения.
По объему производства ферменты занимают третье место после аминокислот и антибиотиков. Из более чем 2000 известных в настоящее время ферментов впромышленности используется около 30. Основная часть ферментов, поступающих на мировой рынок, приходится на долю гидролаз, из которых 60 % составляют пептидогидролазы (в основном щелочные и нейтральные протеазы), использующиеся в качестве детергентов в производстве синтетических моющих средств, а 30 % — гликозидазы, применяющиеся в производстве кондитерских изделий, фруктовых и овощных соков. Ферменты находят применение в текстильной, кожевенной, целлюлозо- бумажной, медицинской, химической промышленности.
По прогнозам ученых, основным потребителем ферментов в ближайшем будущем остается пищевая промышленность. Главное место среди этих энзимов занимают глюкоизомераза и глюкоамилаза, применяющиеся для приготовления обогащенных фруктозой кукурузных сиропов и составляющие около 50 % рынка пищевых энзиматических препаратов.
Все большее развитие получают технологические процессы с участием сложных энзиматических систем, включающих коферменты. Так, созданы ферментные мембранные реакторы, катализирующие непрерывные процессы с регенерацией НАДН (восстановительное аминирование кетокислот, восстановление а-кетокислот в а-гидроксикислоты). Разработаны системы разделения рацематов посредством стереоспецифического активного транспорта. Например, мембрана, содержащая гексокиназу и фосфатазу, функционирует как насос, избирательно прокачивающий лишь D-глюкозу. Применение сопряженных ферментативных реакций с участием алкогольоксидазы и катал азы дрожжейHansenullapolimorphaи формальдегиддисмутазы бактерииPseudomonasputida позволило осуществить окисление метанола в муравьиную кислоту с выходом 88 — 94%. В промышленности большое будущее имеют ферменты, способные катализировать химические реакции в органической фазе, в частности липазы. Существенно, что каталитическая активность панкреатической липазы свиньи сохраняется при концентрации воды в реакционной среде, составляющей всего 0,015 %, и при температуре 100 0С. Препараты липазы используют для синтеза оптически чистых сложных эфиров и феромонов, применяющихся в парфюмерии и медицине.
Для деградации и модификации антропогенных органических соединений, поступающих в окружающую среду, используют ферменты разных классов и в том числе лакказу, лигниназу, тирозиназу, монооксигеназу, диоксигеназу и др. Перспективна для очистки сточных вод новая технология, основанная на использовании реакции пластеинообразования, открытой А.Я. Данилевским в 1886 г. Сущность работ Данилевского состоит в экспериментальном доказательстве обращения протеолиза и возможности синтеза белковоподобных веществ (пластеинов) под действием ряда протеолитических ферментов. Сточные воды содержат аминокислоты и пептиды, концентрация которых возрастает в результате гидролиза белковых компонентов отходов под воздействием пептидогидролаз микроорганизмов. Данная технология, активно внедряющаяся воФранции, нацелена на производство в промышленных масштабах кормовых белков из аминокислот и пептидов сточных вод.
Ферменты широко используют в медицине, например в заместительной терапии в составе лечебных препаратов. Пероральное введение фенилаланин-аммиаклиазы снижает уровень фенилаланина в крови при фенилкетонурии. Протеолитические ферменты, амилазу и липазу применяют при заболеваниях желудочно-кишечного тракта и печени. В последние годы накопились данные об эффективности применения протеиназ в энзимотерапии злокачественных новообразований. Это объясняется большей проницаемостью мембран раковых клеток для гидролитических ферментов в сравнении с нормальными клетками, благодаря чему опухолевые клетки быстро лизируются при введении смеси протеиназ (препарат «папайотин»), Протеолитические ферменты — плазмин и активирующие его стрептокиназу и урокиназу используют длярастворения тромбов в кровеносных сосудах; коллагеназу — для рассасывания рубцовых образований; эластазу — для задержки развития атеросклероза; лизоцим — для лечения конъюнктивитов; дезоксирибонуклеазу из стрептококка (стрептодорназа) — для лечения заболеваний верхних дыхательных путей и роговицы глаза.
Важнейшую область применения ферментов в медицине составляет энзимодиагностика — тестирование патологии того или иного органа человека по уровню активности фермента или соотношению его множественных форм и изоферментов. Так, аспартатаминотрансфераза, изоцитратдегидрогеназа, лактатдегидрогеназа и альдолаза служат для выявления инфаркта миокарда; аланина- минотрансфераза, аспартатаминотрансфераза и лактатдегидрогеназа — для диагностики заболеваний печени; глутамилтрансфераза — для блокировки отторжения органов при их пересадке и т.д.
Таким образом, производство ферментных препаратов занимает одно из ведущих мест в современной биотехнологии и относится к тем ее отраслям, объем продукции которых постоянно растет, а сфера применения неуклонно расширяется. По объему производства ферментов доминируют страны Западной Европы. Резкий рост этой индустрии наблюдается в США и Японии.
3. Источники ферментов
Ферменты присущи всем живым существам, однако для их выделения используют те природные объекты, в которых содержание искомого энзима составляет не менее 1 %. Для крупномасштабного получения ферментов пригодны только некоторые растительные организмы на определенной фазе их развития (проросшее зерно различных злаков и бобовых, латекс и сок зеленой массы ряда растений), а также отдельные ткани и органы животных (поджелудочная железа, слизистая оболочка желудочно-кишечного тракта, сычуг крупного рогатого скота, семенники половозрелых животных). Практически неограниченный источник ферментов — микроорганизмы (бактерии, грибы, дрожжи), содержащие набор большинства известных в настоящее время энзимов, количество которых можно повысить в десятки и сотни раз методами мутагенеза, селекции и индукции биосинтеза.
4. Технология культивирования микроорганизмов - продуцентов ферментов
В зависимости от источника технология получения ферментных препаратов имеет свои особенности. При извлечении ферментов из растительного сырья и животных тканей технология сводится к экстракции энзимов и очистке их отсопутствующих балластных веществ. Технология ферментных препаратов микробного происхождения более сложная, так как дополнительно включает этапы культивирования микроорганизмов — продуцентов ферментов, в том числе этапы получения посевного материала и производственной культуры соответствующего микроорганизма.
Для производства посевного материала используют исходный штамм продуцентов, получаемый из лабораторных чистых культур, который выращивают разными способами на предварительно стерилизованной твердой или жидкой питательной среде до определенного возраста. Посевной материал консервируют (высушиванием или хранением при низких температурах) вплоть до дальнейшего использования. Производственные культуры продуцента получают, выращивая посевной материал микроорганизмов как на поверхности твердых или жидких сред, так и в глубине жидких питательных сред.
Поверхностный метод выращивания продуцентов, предложенный И.Такамине еще в 1894 г., состоит в культивировании микроорганизмов на поверхности увлажненных стерилизованных отрубей, «размещенных в кюветах, к которым иногда добавляют солодовые ростки, древесные опилки, свекловичный жом. Инкубацию микроорганизмов ведут в специальном термостатируемом цехе при постоянном контроле в нем температуры, влажности и подачи воздуха.
В последние 15 лет для выращивания продуцентов ферментов, чаще используют более экономный — глубинный метод культивирования (рис. 1). В промышленных условиях для этих целей применяют ферментеры из нержавеющей стали, снабженные приспособлениями для перемешивания и подачи в жидкую питательную среду стерильного воздуха. Сначала ферментер заполняют питательной средой, автоклавируют, а затем засевают чистой культурой, подаваемой из специального генератора. Для предотвращения инфекции в ферментере поддерживают повышенное давление наряду с оптимальными значениями рН, температуры, редокспотенциала и другими условиями культивирования.
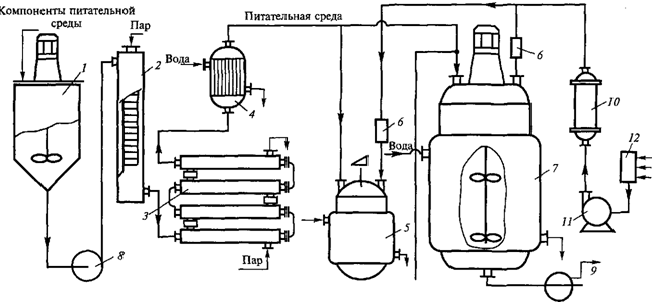
Рис. 1. Принципиальная технологическая схема глубинного культивирования микроорганизмов(по А.А.Свитцову и др., 1986):1-смеситель питательной среды; 2 — стерилизатор в непрерывном режиме потока питательной среды; 3, 4 — теплообменники; 5 — посевные аппараты; 6, 10, 12 — фильтры для очистки воздуха; 7 — ферментер; 8, 9 — насосы; 11 — компрессор.
В настоящее время наиболее прогрессивным признан проточный метод культивирования микроорганизмов, который обеспечивает непрерывную подачу в ферментер как питательной среды, так и посевного материала. Размножение микроорганизмов и биосинтез фермента регулируют при использовании этого метода по мере поступления питательной смеси в ферментер. Такой ферментер представляет собой вращающийся трубкообразный реактор, через один конец которого в него поступает питательная среда и культура микроорганизмов, а из другого — выводятся ферменты, продукты жизнедеятельности и бактериальная масса. Основное достоинство метода — возможность длительное время поддерживать в автоматическом режиме рост культуры микроорганизма. Например, культура ацетонобутиловых бактерий находилась в таком реакторе в состоянии непрерывного размножения в течение 200 суток (И.Д.Иерусалимский с сотр., 1986).
Важнейшим фактором эффективности технологии ферментных препаратов является качество питательной среды. Основное требование к качеству питательной среды состоит в полноценности ее состава, обеспечивающей рост продуцента и биосинтез целевого фермента. Микроорганизмы нуждаются прежде всего в соединениях, содержащих углерод, азот, водород и кислород. К ним относятся органические вещества, соли аммония и вода. Кроме того, в состав питательной среды должны быть включены минеральные соединения, содержащие Mg, Са, Р, S, Fe, К и другие макро- и микроэлементы, витамины, ростовые вещества (биотин, инозит) и пр. Питательные среды в зависимости от состава делятся на синтетические и комплексные. Синтетическими считают те среды, которые состоят из определенного по качественному и количественному составу набора индивидуальных веществ. В комплексные среды входят различные природные продукты, часто отходы пищевых производств. К их числу относятся различные жмыхи, барда спиртовых заводов, картофельная мезга, кукурузный экстракт, меласса, отруби и прочие продукты. Благодаря использованию отходов комплексные питательные среды доступны, дешевы и обеспечивают безотходность биотехнологических производств.
4.1 Технология выделения и очистки ферментных препаратов
Выделение и очистка фермента как из культуры микроорганизма (выращенного любым способом), так и из других природных источников весьма трудоемкая и дорогостоящая процедура, поэтому, если фермент можно использовать в виде неочищенного препарата, его не очищают. В промышленности широко применяют коммерческие препараты ферментов, чистота которых составляет всего 0,1 % (т.е. 99,9 % составляют примеси). К таким отраслям относятся спиртовая, кожевенная, текстильная промышленность, а также сельское хозяйство, производство бытовой химии. Например, ферментный препарат, употребляемый в пивоварении, представляет собой высушенную биомассу плесневых грибов. В большинстве отраслей пищевой промышленности, практике научных исследований и особенно в медицине используют только очищенные препараты ферментов, частично или полностью освобожденные от балластных веществ и полностью охарактеризованные в отношении их специфичности и физико-химических свойств. Исходным материалом для получения препаратов ферментов служат: биомасса продуцента, фильтрат культуральной жидкости, экстракт из культуры микроорганизма или из тканей и органов растений и животных, из которых готовят препараты различной степени очистки.
Неочищенные ферментные препараты получают путем высушивания в мягком режиме культуры микроорганизмов вместе с остатками питательной среды. Такие препараты получают и путем упаривания экстракта из культуры продуцента, выращенного поверхностным способом, или из фильтрата культуральной жидкости (в случае глубинного выращивания микроорганизмов). Распространен также метод ацетоновых порошков, состоящий в осаждении и быстром обезвоживании при температуре не выше -10°С тканей или вытяжек из них, содержащих ферменты. Технические препараты ферментов представляют собой либо высушенные до порошкообразного состояния продукты, либо жидкие концентраты, обычно характеризующиеся 50 %-м содержанием сухой массы веществ.
Для успешного выделения ферментов из клеточного содержимого необходимо очень тонкое измельчение исходного материала вплоть до разрушения субклеточных структур: лизосом, митохондрий, ядер и др., которые имеют в своем составе многие индивидуальные ферменты. Для этого используют специальные мельницы и гомогенизаторы, а также ультразвук, метод попеременного замораживания и оттаивания ткани. Для высвобождения ферментов из мембранных структур клетки к гомогенатам добавляют небольшие количества детергентов (твин, тритон Х-100) или обрабатывают их энзимами — лизоцимом, целлюлазой, лецитиназой С. Особое внимание при выделении ферментов уделяют проведению всех операций в условиях, исключающих денатурацию белка (нейтральные значения рН, стабилизирующие добавки в виде белков, солей и специальных соединений).
Пример, иллюстрирующий получение частично очищенного препарата (ᵝ-галактозидазы из мутанта Е. coli,представлен на рис. 2. Схема очистки включает отделение клеток микроорганизма повыходе их из ферментера от культуральной жидкости посредством центрифугирования и последующее разрушение клеток в гомогенизаторе высокого давления. Для освобождения белков от нуклеиновых кислот полученный гомогенат обрабатывают сульфатом марганца до конечной концентрации этой соли в смеси, равной 0,05 М. Осадок нуклеиновых кислот отделяется с помощью ротационной вакуум-фильтрации, а в образовавшийся фильтрат добавляют сульфат аммония до 45 % от его насыщения. Возникший осадок белков, содержащий ᵦ-галактозидазу, собирают с помощью центрифугирования или вакуум-фильтрации. Всяпроцедура очистки энзима от момента подачи бактерий в систему до момента получения осадка ᵝ-галактозидазы занимает всего 1 ч.
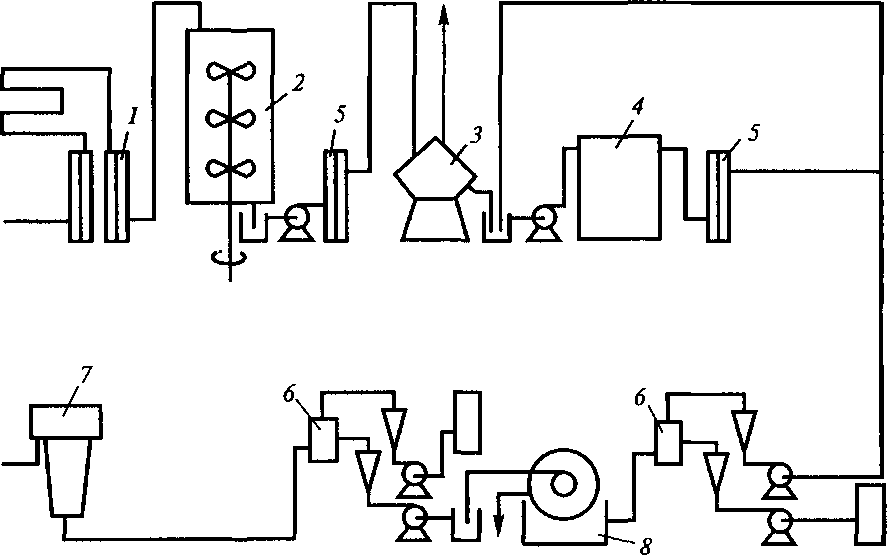
Рис. 2. Технологическая схема непрерывного получения Р-галактозидазы из клеток Е. coliML308 (поP.P.Grayetal., 1972):1 — стерилизатор среды; 2— ферментер; 3, 7 — центрифуги; 4 — гомогенизатор; 5 — теплообменник; 6 — смесительные камеры; 8 — ротационный вакуум-фильтр.
В зависимости от свойств выделяемого фермента и сопутствующих ему балластных веществ при получении очищенных препаратов ферментов комбинируют различные приемы и методы, такие, как термическое фракционирование, осаждение органическими растворителями, солями и тяжелыми металлами, фильтрация на молекулярных ситах, ионообменная хроматография, электрофорез, изоэлектрофокусирование.
На заключительных этапах очистки часто используют аффинную хроматографию (биоспецифическая хроматография, хроматография по сродству), которая основана на способности ферментов избирательно связывать те или иные лиганды — субстраты, коферменты, конкурентные ингибиторы, аллостерические эффекторы и т.п. Такое связывание весьма специфично, что позволяет выделить тот или иной энзим из множества других белков. Например, из желудочного сока человека методом одноэтапной аффинной хроматографии выделена кислая липаза, использующаяся в заместительной терапии при заболеваниях печени.
Для синтеза аффинного сорбента, соответствующего специфичности данного фермента, лиганд (субстрат или его аналог) присоединяют к инертной матрице (макропористые гидрофильные гели, синтетические полимеры, неорганические носители). Для уменьшения пространственных трудностей при взаимодействиифермента с матрицей лиганд присоединяют к носителю через промежуточное звено (вставку, ножку, спейсер). Присоединение лигандов к поперечносшитой агарозе — сефарозе обычно проводят, активируя ее бромцианом (см. с. 91). Связывание с сефарозой, активированной бромцианом, л-амино-бензилянтарной кислотой, используемой в качестве лиганда, обеспечивает взаимодействие сорбента с каталитическим центром только карбоксипептидаз благодаря сходству лиганда с субстратами карбоксипептидазы:
| —со—NH-CH-COOH НО-СО-СН-СН-СООН
Матрица—О—С—NH II О С-концевой остаток Аффинный сорбент с лигандом. фенилаланина в субстрате Бензилянтарная кислота изостерична карбоксипептидазы структуре остатка фенилаланина |
В процессе выделения повышается доля фермента в массе тотальных белков, т.е. увеличивается его удельная активность.
В производственных условиях активность получаемого ферментного препарата оценивается количеством субстрата, преобразованного 1 мг (1кг) препарата при оптимальных условиях за 1 мин, и измеряется в Е/мг, моль/мг или каталах/кг белка.
Очищенные ферментные препараты хранят при низкой температуре (до -80 °С). Для стабилизации ферментов в их препараты добавляют коферменты и субстраты. Ферментные препараты для промышленного применения стабилизируют, добавляя глицерин, моносахариды, дисахариды (глюкоза, сахароза, лактоза), HS-coединения (цистеин, глутатион, меркаптоэтанол, дитиотреитол и др.), отдельные аминокислоты, желатину и другие белки-наполнители.
Существенно, что из 2003 включенных в список известных в настоящее время ферментов более 1500 выделено и в той или иной степени очищено; это служит не только базой для изучения физико-химических основ ферментативного катализа, но и фундаментом для совершенствования химического производства и промышленности.
5. Инженерная энзимология, ее задачи
Развитие прикладной энзимологии долгое время сдерживалось дороговизной чистых ферментных препаратов, неустойчивостью их при хранении и невозможностью многократного использования. Принципиально новые перспективы открылись перед прикладной энзимологией в 60-е годы XX в. в результате появления на стыке химии и биологии новой отрасли — инженерной энзимологии. Ее задачи заключаются в развитии прогрессивных методов выделения ферментов, их стабилизации и иммобилизации; конструировании катализаторов с нужными свойствами и разработке научных основ их применения.
В частности, методами белковой инженерии, сущность которых состоит в изменении первичной структуры природной молекулы фермента посредством химической модификации самого; энзима или его гена, удается принципиально трансформировать структуру активного центра и его функцию, модулировать субстратную специфичность и физико-химические свойства фермента. Так, замена остатка глутамина-102 в молекуле лактатдегидрогеназы на аргинин превратила фермент в высокоактивную малатдегидрогеназу. Описанным способом получены термостабильные формы лизоцима Т-4 и субтилизина (каталитическая константа субтилизина изменена в 100 раз), созданы гибридные формы ферментной системы, ценной в иммуноферментном анализе, сочетающие в себе свойства Р-галактозидазы и Р-галактокиназы.
Многие проблемы технологии синтеза органических соединений, пищевой и медицинской промышленности, мониторинга человека и окружающей среды, защиты окружающей среды, энергетики не могут быть решены без использования методов современной инженерной энзимологии.
Важным этапом развития инженерной энзимологии стала разработка способов получения и использования иммобилизованных ферментов.
6. Иммобилизованные ферменты
Иммобилизованными ферментами называются ферменты, искусственно связанные с нерастворимым носителем, но сохраняющие свои каталитические свойства.
Еще в 1916 г. Дж. Нельсон и Е.Гриффин показали, что сахароза, сорбированная на угле, сохраняла свою каталитическую активность, но лишь в 1953 г. Н. Грубхофер и Д. Шлейт впервые осуществили ковалентные связывания амилазы, пепсина, РНКазы и карбоксипептидазы с нерастворимым носителем.
В 1971 г. на первой конференции по инженерной энзимологии был узаконен термин «иммобилизованные ферменты». Однако в понятие «иммобилизация» в настоящее время вкладывают более широкий смысл, чем связывание на нерастворимом носителе, а именно — полное или частичное ограничение свободы движения белковых молекул.
Иммобилизация – физическое разделение биообъекта (клетка, фермент) ирастворителя, то есть биообъект закреплен на нерастворимом носителе, асубстрат и продукты свободно обмениваются между биообъектом ирастворителем.
Биообъект может работать в этом случае многократно (неделя, месяц).Другими словами можно сказать, что иммобилизация ферментов – этоперевод их в нерастворимое состояние с сохранением частичным илиполным) каталитической активности.
Преимущества иммобилизации биообъекта:
1. многократность использования ферментов и живых клеток в наиболеепродуктивной фазе
2. снижение количества отходов производства
3. повышение качества целевого продукта (он менее загрязнен), болеепростое выделение целевого продукта (особенно важно для производстваинъекционных лекарственных препаратов, когда в продукте мало белка –нет пирогенности и аллергенности).
4. биотехнологический процесс становится более стандартным, болеепредсказуемым.
5. устойчивость к внешним воздействиям.
Для получения иммобилизованных ферментов обычно применяютследующие методы:
1. Ковалентное присоединение молекул ферментов к водонерастворимомуносителю, в качестве которого используют как органические (природные исинтетические) полимеры, так и неорганические материалы. К природнымматериалам относятся целлюлоза, хитин, агароза, декстраны, бумага,ткани, полистирол, ионообменные смолы и так далее.
2. Захват фермента в сетку геля или полимера.
3. Ковалентная сшивка (сшивание) молекул фермента друг с другом или синертными белками при помощи би- или полифункционального реагента.
4. Адсорбция фермента на водонерастворимых носителях (часто на ионитах)
5. Микрокапсулирование (захват раствора фермента в полупроницаемыекапсулы размером 5-300 миллимикрон).
Такая ситуация приводит к совершенствованию технологических процессов.
В результате иммобилизации ферменты приобретают преимуществагетерогенных катализаторов – их можно удалять из реакционной смеси (иотделять от субстратов и продуктов ферментативной реакции) простойфильтрацией. Кроме того, появляется возможность перевода многихпериодических ферментативных процессов на непрерывный режим,используя колонны или проточные аппараты с иммобилизованными
ферментами.
Иммобилизованные ферменты долговечны и в тысячи и десятки тысяч раз стабильнее свободных энзимов. Так, происходящая при температуре 65°С термоинактивация лактатдегидрогеназы, иммобилизованной в 60%-м полиакриламидном геле, замедлена в 3600 раз по сравнению с нативным ферментом. Все перечисленное обеспечивает высокую экономичность, эффективность и конкурентоспособность технологий, использующих иммобилизованные ферменты.
Ограничения метода иммобилизации:
• если целевой продукт не выходит в среду растворителя, анакапливается внутри клетки, то работать с иммобилизованнымпродуктом нет смысла.
• Ферменты тоже не всегда можно иммобилизовать, например, если уфермента есть кофермент, который с ним не прочно связан.
Кофермент можно вводить в среду, но это не всегда бываетвозможно, в условиях производства.
Пути иммобилизации ферментов и целых клеток
1. Адсорбция на нерастворимом носителе (на окиси алюминия, угле, смолах,карбоксиметилцеллюлозе и др.)
Адсорбция имеет недостаток, так как связи (в основном ионные) могутбыть недостаточно прочными и разрушаться под воздействием рН идругих факторов, при этом биообъект снимается с носителя. Впроизводстве используется редко.
2. Адсорбция на аффинном носителе (избирательная сорбция к определеннойгруппе веществ)
3. Ковалентное связывание. Носитель активируют, например ПААГактивируют бромцианом или глутаровым альдегидом. Носитель недолжен быть токсичным для биообъекта.Максимальная нагрузка носителя – это максимальное количество фермента,которое может быть иммобилизовано на определенном количестве носителя.Чем она больше, тем лучше.
4. Включение биообъекта в носитель или инкапсулированиеБиообъект включается в ячейки геля, субстрат проникает в ячейки, ацелевой продукт свободно выходит.
Сложности, возникающие приинкапсулировании.
Если биообъект – изолированный очищенный фермент, то для еговключения в гель ячейки не должны быть слишком большими. Но, еслиячейки слишком маленькие, то затруднен контакт с субстратом инеобходимо подбирать условия, чтобы субстрат свободно проникал исвободно уходил целевой продукт. Если биообъект – клетки, то ячейкидолжны быть достаточно большими. Необходим достаточный доступ кклеткам кислорода и отведения углекислого газа.Связь с гелем не очень прочная и биообъект может вымываться.
Таблица 1.
Иммобилизация биообъекта
| Биообъект | Технологическая операция |
| 1.Очищенный фермент | Катализирует отдельную реакцию, одноступенчатая трансформация, биоконверсия. |
| 2. Фермент сохраняется в клетке с Коферментом | Отдельная реакция |
| 3. Фермент в пермеабилизированной клетке (в клетке, у которой повышена проницаемость | Отдельная реакция |
| 4. Интактная клетка с полной функциональной активностью (клетка-продуцент) | Цепь реакций – полный биосинтез целевого продукта |
| 5. Система, открытая для усложнения, клетка-фермент + и т.д. | Биосинтез продукта и его трансформация в одном биореакторе. |
Рис.3.Аппаратное оформление
Путем микробиологического синтеза для медицинских целей получаютследующие ферментные препараты:
• Солизим (липолитический фермент, гидролизующий жиры, применяетсяпри желудочно-кишечных заболеваниях)α-амилаза (сахаролитический фермент), гидролизующий крахмал, которыйвходит в состав лечебного препарата «Фестал», используется принедостаточной функции поджелудочной железы.
• Террилитин (протеолитический фермент), рекомендуется при лечениигнойных ран, ожогов, трофических язв.
• Стрептокиназа (фибринолитический фермент), используется при тромбозах β-галактозидаза (сахаролитический фермент) используется при лактазнойнедостаточности.
• Традиционные биотехнологии, основанные на переработке тканей животныхпредставлены
• Трипсином, химотрипсином (протеолитические ферменты) используются длярассасывания рубцов и спаек.
• Урокиназой (протеолитический фермент) используется при лечении тромбозов
• Пепсином (протеолитический фермент), используется при расстройствахпищеварения.
6.1. Носители для иммобилизации ферментов
По Дж. Порату (1974), идеальные материалы, используемые для иммобилизации ферментов, должны обладать следующими основными свойствами: нерастворимостью; высокой химической и биологической стойкостью; значительной гидрофильностью; достаточной проницаемостью как для ферментов, так и для коферментов, субстратов и продуктов реакции; способностью носителя легко активироваться (переходить в реакционноспособную форму).
Естественно, ни один из используемых в настоящее время в качестве носителя материал не отвечает полностью перечисленным требованиям. Тем не менее, существует широкий набор носителей, пригодных для иммобилизации определенных энзимов в конкретных условиях.
В зависимости от природы носители делятся на:
· органические,
· неорганические материалы.
Органические полимерные носители. Иммобилизация многих ферментов осуществляется на полимерных носителях органической природы. Существующие органические полимерные носители можно разделить на два класса: природные и синтетические полимерные носители. В свою очередь, каждый из классов органических полимерных носителей подразделяется на группы в зависимости от их строения. Среди природных полимеров выделяют белковые, полисахаридные и липидные носители, а среди синтетических — полиметиленовые, полиамидные и полиэфирные.
К преимуществам природных носителей следует отнести их доступность, полифункциональность и гидрофильность, а к недостаткам — биодеградируемость и достаточно высокую стоимость.
Из полисахаридов для иммобилизации наиболее часто используют целлюлозу, декстран, агарозу и их производные. Для придания химической устойчивости линейные цепи целлюлозы и декстрана поперечно сшивают эпихлоргидрином. В полученные сетчатые структуры довольно легко вводят различные ионогенные группировки. Химической модификацией крахмала сшивающими агентами (формальдегид, глиоксаль, глутаровый альдегид) синтезирован новый носитель — губчатый крахмал, обладающий повышенной устойчивостью к гликозидазам.
Из природных аминосахаридов в качестве носителей для иммобилизации применяют хитин, который в значительных количествах накапливается в виде отходов в процессе промышленной переработки крабов и креветок. Хитин химически стоек и имеет хорошо выраженную пористую структуру.
Среди белков практическое применение в качестве носителей нашли структурные протеины, такие, как кератин, фиброин, коллаген и продукт переработки коллагена — желатина. Эти белки широко распространены в природе, поэтому доступны в значительных количествах, дешевы и имеют большое число функциональных групп для связывания фермента. Белки способны к биодеградации, что очень важно при конструировании иммобилизованных ферментов для медицинских целей. К недостаткам белков как носителей в этом случае следует отнести их высокую иммуногенность.
Синтетические полимерные носители. Благодаря разнообразию и доступности материалы этой группы широко используются как носители для иммобилизации. К ним относятся полимеры на основе стирола, акриловой кислоты, поливинилового спирта; полиамидные и полиуретановые полимеры. Большинство синтетических полимерных носителей обладают механической прочностью, а при образовании обеспечивают возможность варьирования в широких пределах величины пор, введения различных функциональных групп. Некоторые синтетические полимеры могут быть произведены в различных физических формах (трубы, волокна, гранулы). Все эти свойства полезны для разных способов иммобилизации ферментов.
Носители неорганической природы. В качестве носителей наиболее часто применяют материалы из стекла, глины, керамики, графитовой сажи, силикагеля, атакже силохромы, оксиды металлов. Их можно подвергать химической модификации, для чего носители покрывают пленкой оксидов алюминия, титана, гафния, циркония или обрабатывают органическими полимерами. Основное преимущество неорганических носителей—легкость регенерации. Подобно синтетическим полимерам неорганическим носителям можно придать любую форму и получать их с любой степенью пористости.
Итак, к настоящему времени создано огромное число разнообразных носителей для иммобилизации ферментов. Однако для каждого индивидуального фермента, используемого в конкретном технологическом процессе, необходимо подбирать оптимальные варианты как носителя, так и условий и способов иммобилизации.
6.2. Методы иммобилизации ферментов
Существуют два принципиально различных метода иммобилизации ферментов:
Ø без возникновения ковалентных связей между ферментом и носителем (физические методы иммобилизации),
Ø с образованием ковалентной связи между ними (химические методы иммобилизации).
К недостаткам адсорбционного метода следует отнести невысокую прочность связывания фермента с носителем. При изменении условий иммобилизации могут происходить десорбция фермента, его потеря и загрязнение продуктов реакции. Существенно повысить прочность связывания фермента с носителем может предварительная его модификация (обработка ионами металлов, полифункциональными агентами — полимерами, белками, гидрофобными соединениями, монослоем липида и пр.). Иногда, наоборот, модификации подвергается молекула исходного фермента, однако зачастую это ведет к снижению его активности.
Иммобилизация ферментов путем включения в гель. Способ иммобилизации ферментов путем включения в трехмерную структуру полимерного геля широко распространен благодаря своей простоте и уникальности. Метод применим для иммобилизации не только индивидуальных ферментов, но и мультиэнзимных комплексов и даже интактных клеток. Иммобилизацию ферментов в геле осуществляют двумя способами. В первом случае фермент вводят в водный раствор мономера, а затем проводят полимеризацию, в результате которой возникает пространственная структура полимерного геля с включенными в его ячейки молекулами фермента. Во втором случае фермент вносят в раствор уже готового полимера, который впоследствии переводят в гелеобразное состояние. Для первого варианта используют гели полиакриламида, поливинилового спирта, поливинилпирролидона, силикагеля, для второго — гели крахмала, агар-агара, каррагинана, агарозы, фосфата кальция.
Иммобилизация ферментов в гелях обеспечивает равномерное распределение энзима в объеме носителя. Большинство гелевых матриц обладает высокой механической, химической, тепловой и биологической стойкостью и обеспечивает возможность многократного использования фермента, включенного в его структуру. Однако метод непригоден для иммобилизации ферментов, действующих на водонерастворимые субстраты.
Иммобилизация ферментов в полупроницаемые структуры. Сущность этого способа иммобилизации заключается в отделении водного раствора фермента от водного раствора субстрата с помощью полупроницаемой мембраны, пропускающей низкомолекулярные молекулы субстратов и кофакторов, но задерживающей большие молекулы фермента. Разработано несколько модификаций этого метода, из которых интерес представляет микрокапсулирование и включение ферментов в липосомы.
Первый способ предложен Т.Чангом в 1964 г. и состоит в том, что водный раствор фермента включается внутрь замкнутой микрокапсулы, стенки которой образованы полупроницаемым полимером. Один из механизмов возникновения мембраны на поверхности водных микрокапсул фермента заключается в реакции межфазной поликонденсации двух соединений, одно из которых растворено в водной, а другое — в органической фазе. Примером может служить образование на поверхностираздела фаз микрокапсулы, получаемой путем поликонденсации гексаметилендиамина-1,6 (водная фаза) и галогенангидрида себациновой кислоты (органическая фаза):
H2N-(CH2)6-NH2 + СЮС-(СН2)8-СОС1
—ны
—- -HN-(CH2)6-NH - СО—(СН2)8—СО-
Размер получаемых капсул составляет десятки или сотни микрометров, а толщина мембраны — сотые доли микрометра.
Достоинства метода микрокапсулирования — простота, универсальность, возможность многократного использования нативного фермента (фермент может быть отделен от непрореагировавшего субстрата и продуктов реакции процедурой простого фильтрования). Особенно существенно, что методом микрокапсулирования могут быть иммобилизованы не только индивидуальные ферменты, но и мультиэнзимные комплексы, целые клетки и отдельные фрагменты клеток. К недостаткам метода следует отнести невозможность инкапсулированных ферментов осуществлять превращения высокомолекулярных субстратов.
Близким к инкапсулированию методом иммобилизации можно считать включение водных растворов ферментов в липосомы, представляющие собой сферические или ламеллярные системы двойных липидных бислоев. Впервые данный способ был применен для иммобилизации ферментов Дж. Вайсманом и Дж. Сессом в 1970 г. Для получения липосом из растворов липида (чаще всего лецитина) упаривают органический растворитель. Оставшуюся тонкую пленку липидов диспергируют в водном растворе, содержащем фермент. В процессе диспергирования происходит самосборка бислойных липидных структур липосомы, содержащий включенный раствор фермента.
Ферменты, иммобилизованные путем включения в структур липосом, используют преимущественно в медицинских и научных целях, ибо значительная часть ферментов в клетке локализована в составе липидного матрикса биологических мембран, поэтому изучение липосом имеет большое значение для пониманий закономерностей процессов жизнедеятельности в клетке.
Другие приемы иммобилизации ферментов, основанные физических методах, менее распространены по сравнению с рассмотренными выше.
Химические методы иммобилизации ферментов. Иммобилизация ферментов путем образования новых ковалентных связей между ферментом и носителем — наиболее массовый способ получений промышленных биокатализаторов.
В отличие от физических методов этот способ иммобилизации обеспечивает прочную и необратимую связь фермента с носителем и часто сопровождается стабилизацией молекулы энзима. Однако расположение фермента относительно носителя на расстоянии одной ковалентной связи создает стерические трудности восуществлении каталитического процесса. Фермент отделяют от носителя с помощью вставки (сшивка, спейсер), в роли которой чаще всего выступают бифункциональные и полифункциональные агенты (бромциан, гидразин, сульфурилхлорид, глутаровый диальдегид и др.). Например, для выведения галактозилтрансферазы из микроокружения носителя между ним и ферментом вставляют последовательность —СН2—NH—(СН2)5—СО—. В этом случае структура иммобилизованного фермента включает носитель, вставку и фермент, соединенные между собой ковалентными связями.
Принципиально важно, чтобы в иммобилизации фермента участвовали функциональные группы, не существенные для его каталитической функции. Так, гликопротеины обычно присоединяют к носителю через углеводную, а не через белковую часть молекулы фермента.
Число методических приемов, разработанных для осуществления ковалентной иммобилизации ферментов, исключительно велико. Все методы химической иммобилизации классифицируют в зависимости от природы реакционной группы носителя, вступающей во взаимодействие с молекулой фермента. Ниже представлен ряд примеров, иллюстрирующих некоторые способы химической иммобилизации ферментов.
Иммобилизация ферментов на носителях, обладающих гидроксогруппами. Наиболее распространенным методом образования ковалентной связи между ферментом и полисахаридным носителем или синтетическим диольным соединением является бромциановый метод, который был предложен Р.Аксеном, Дж.Поратом и С. Эрнбаком в 1967 г. При обработке носителя бромцианом возникают реакционноспособные цианаты и имидокарбонаты, которые при взаимодействии с нуклеофильными аминогруппами фермента образуют производные изомочевины и уретанов.
Иммобилизация путем химического присоединения биокатализатора к носителю отличается высокой эффективностью и прочностью связи. Несмотря на это, методы ковалентной иммобилизации ферментов все еще малодоступны для промышленного использования в связи со сложностью и дороговизной их применения. Однако они остаются незаменимыми инструментами в практике проведения научных и лабораторных исследований по созданию энзимов с контролируемыми свойствами.
6.3. Иммобилизация клеток
Методы иммобилизации универсальны для всех видов иммобилизованных биокатализаторов — индивидуальных ферментов, клеток, субклеточных структур, комбинированных препаратов.
Наряду с иммобилизацией ферментов в последнее время все большее внимание уделяется иммобилизации клеток и субклеточных структур. Это объясняется тем, что при использовании иммобилизованных клеток отпадает необходимость выделения и очистки ферментных препаратов, применение кофакторов; создается возможность получения полиферментных систем, осуществляющих многостадийные непрерывно действующие процессы.
В промышленных процессах чаще используют покоящиеся клетки. Действительно, многие хозяйственно-ценные продукты синтезируются главным образом в стационарной фазе развития клеточных культур. Растущие клетки нарушают структуру носителя. Образующиеся при делении дочерние клетки, покидая носитель, загрязняют целевой продукт. Для подавления роста иммобилизованных клеток растений используют дефицит фитогормонов, а рост клетки бактерий тормозят добавлением антибиотиков.
Иммобилизованные клетки микроорганизмов применяют для биотрансформации органических соединений, разделения рацемических смесей, гидролиза ряда сложных эфиров, инверсии сахарозы, восстановления и гидроксилирования стероидов. Иммобилизованные хроматофоры используют в лабораторных установках для синтеза АТФ, а пурпурные мембраны — для создания искусственных фотоэлектрических преобразователей — аналогов солнечных батарей. Разрабатывается реактор на основе иммобилизованных клеток дрожжей для получения этанола из мелассы, в котором дрожжи сохраняли бы способность к спиртовому брожению в течение 1800 ч. Из более чем 2000 известных в настоящее время ферментов иммобилизована и используется для целей инженерной энзимологии примерно десятая часть (преимущественно оксидоредуктазы, гидролазы и трансферазы).
Для осуществления химических процессов с помощью иммобилизованных ферментов применяют колоночные, трубчатые, пластинчатые и танкерные реакторы разного объема и производительности. Иммобилизованные ферментные системы функционируют в биореакторе в виде неподвижной фазы, через которую протекает среда с субстратом, подлежащим химическому превращению (гетерогенный катализ). В таких реакторах наряду с непрерывным режимом используется и периодический. Для эффективного перемешивания и газообмена биореактор снабжают мешалкой. Повреждающее действие мешалки на биокатализатор устраняют, закрепляя определенным образом его гранулы. Например, в биореакторе «корзиночного» типа мешалка вращается в полом цилиндре из сетчатой структуры (корзина), в ячейках которой закреплен иммобилизованный фермент. Во внутреннем объеме трубчатых реакторов рыхло расположены полые волокна, заполненные биокатализатором. Степень превращения субстрата в продукт (например, фумарата аммония в аспартат) в таких реакторах достигает 90 %.
6.4. Промышленные процессы с использованием иммобилизованных ферментов и клеток
Сочетание уникальных каталитических свойств энзимов с преимуществами иммобилизованных ферментов как гетерогенных катализаторов позволило создать новые промышленные технологические процессы. Следует отметить, что все они относятся к производству пищевых продуктов и лекарственных препаратов.
В настоящее время в мире разработаны следующие крупномасштабные производства с использованием иммобилизованных ферментов и клеток:
v Получение глюкозофруктозных сиропов.
v Получение оптически активных L-аминокислот из их рацемических смесей.
v Синтез L-аспарагиновой кислоты из фумарата аммония.
v Синтез L-аланина из L-аспарагиновой кислоты.
v Синтез L-яблочной кислоты из фумаровой кислоты.
v Получение безлактозного молока.
v Получениесахаров из молочной сыворотки.
v Получение 6-аминопенициллановой кислоты.
В качестве примера рассмотрим некоторые из них.
Получение глюкозофруктозных сиропов. Фруктоза (фруктовый, плодовый или медовый сахар) — важнейший в физиологическом и технологическом отношении природный моносахарид. Превращаясь в печени и кишечнике млекопитающих в глюкозу, фруктоза включается в пластический и энергетический обмен клетки. Она в 2,5 раза слаще глюкозы и в 1,7 раза слаще тростникового сахара (сахароза), благодаря чему фруктоза — менее калорийный пищевой продукт по сравнению с последними. Вотличие от глюкозы обмен фруктозы не контролируется инсулином, поэтому фруктовый сахар может потребляться больными диабетом. Фруктоза практически не вызывает кариеса зубов. В смеси с глюкозой фруктоза не кристаллизуется, поэтому широко используется для производства кондитерских изделий.
Объем производства сахарозы за последние 100 лет возрос в 15 раз и составляет, по разным оценкам, 30 — 40 кг в год на человека. Однако, несмотря на явные преимущества использования фруктозы, первая промышленная установка для превращения глюкозы во фруктозу с помощью иммобилизованной глюкоизомеразы была запущена лишь в 1973 г. (компания «Клинтон Корн», США). Исходным сырьем для этого процесса служит глюкоза, которую получают при гидролизе кукурузного или картофельного крахмала в присутствии минеральных кислот. Для конструирования промышленного биокатализатора глюкозоизомеразу сорбируют на пористых неорганических носителях или ионообменных смолах. Во многих случаях используют иммобилизованные клетки разного происхождения(Aspergillusniger, A. oryzae, Streptomycesphaeochromogenes, S. olivaceus, S. Venezuela).Коммерческие препараты иммобилизованной глюкоизомеразы имеют вид гранул, шариков, волокон или аморфной массы. Наиболее эффективными биореакторами для получения фруктозы признаны аппараты колонного типа высотой около 5 м, в которых по сравнению с реакторами перемешивания расход фермента минимален. Производительность такого реактора варьирует от 600 до 9000 кг глюкозофруктозного сиропа на 1 кг иммобилизованного фермента в зависимости от чистоты исходного сырья, а время полуинактивации катализатора — 20 — 50 суток. Возникающий в результате каталитического процесса глюкозофруктозный сироп содержит 42 —45 % фруктозы, около 51 % глюкозы, небольшое количество олигосахаридов и по сладости соответствует инвертному сахару, получаемому при гидролизе сахарозы. Эти смеси постепенно вытесняют инвертированный сахар в промышленности и медицине. Глюкозофруктозную смесь широко применяют для производства тонизирующих напитков, консервированных фруктов, кондитерских изделий, хлеба, мороженого и пр. Экономические расчеты показали, что производство глюкозофруктозных сиропов с использованием иммобилизованной глюкоизомеразы в 1,5 раза выгоднее получения сахарозы из сахарной свеклы по традиционной технологии. Благодаря этому обстоятельству производство глюкозофруктозных сиропов в мире постоянно растет. Так, в 1980 г. 10 % потребляемого населением Японии сахара заменено на глюкозофруктозную смесь. В США эта доля к началу нового столетия достигла 40 %.
Получение L-аминокислот из их рацемических смесей. Наряду с микробиологическими способами. важное значение имеют химические методы промышленного получения природных аминокислот, в том числе незаменимых. Однако в результате химических реакций, используемых для синтеза аминокислот, содержащих асимметрические атомы углерода, с одинаковой скоростью образуются как D-, так и L-стереоизомеры, т.е. всегда возникает рацемическая смесь. Между тем в живых клетках обмену подвергаются лишь L-аминокислоты. Разделение рацемических смесей на составляющие их оптические изомеры (представляющее труднейшую задачу) явилось первым промышленным процессом с использованием иммобилизованных ферментов. Этот процесс был осуществлен в Японии в 1969 г. (компания «Танабе Сейяку») с помощью аминоацилазы, иммобилизованной на ДЕАЕ-целлюлозе. В качестве исходных соединений в данном превращении используют N-ацилированные производные D-,L-аминокислот, получаемые с помощью химического синтеза. Вследствие своей стереоспецифичности аминоацилаза гидрлизует лишь N-aцил-L-стереоизомер, отщепляя от него ацильный радикал, в результате чего растворимость образующейся L-аминокислоты резко возрастает и ее легко можно отделить от своего антипода физико-химическими методами. При нагревании оставшаясяN-ацил-О-аминокислота рацемизируется, т.е. превращается в исходную смесь, которая вновь подвергается воздействию фермента.
Аминоацилаза строго специфична к структуре только ацильной части субстрата, поэтому одна и та же установка с иммобилизованным ферментом используется для получения различных аминокислот, в том числе L-валина, L-метионина, L-фенилаланина и L-триптофана. Время полуинактивации иммобилизованного энзима составляет 65 суток; на японских предприятиях он используется без замены более 8 лет и обеспечивает снижение стоимости производства аминокислот на 40 % по сравнению с технологией, где применяются свободные молекулы фермента.
Получение L-аспарагиновой кислоты. Аспарагиновая кислота широко употребляется в качестве пищевой добавки (подсластитель и подкислитель). Первая в мире промышленная установка для синтеза L-аспарагиновой кислоты из получаемого химическим путем фумарата аммония была запущена в 1973 г. в Японии (фирма «Танабе
Сейяку»); в ней использованы иммобилизованные в полиакриламидном геле клетки кишечной палочки Е. coli, содержащие аспартат-аммиак-лиазу.
Изложенное, далеко не исчерпывает перечень химических производств, базирующихся на использовании иммобилизованных ферментов и клеток. Список ряда биотехнологических процессов с применением иммобилизованных биокатализаторов, разработанных на уровне промышленных и опытных установок, представлен в таблице2.
Таблица2.
Применение иммобилизованных ферментов


6.5. Биосенсоры на основе иммобилизованных ферментов
Высокая эффективность биологических катализаторов и специфичность их действия делают ферменты идеальными реагентами для аналитической химии. Благодаря этим особенностям с помощью ферментов обнаруживаются вещества при предельно низкой концентрации в присутствии множества других соединений. К настоящему времени созданы искусственные аналитические системы различных конструкций (биосенсоры, датчики, ферментные электроды, проточные анализаторы), содержащие иммобилизованные ферменты и клетки и предназначенные для автоматического детектирования продуктов энзиматического превращения.
Начаты разработки новых поколений биодатчиков на базе аффинных взаимодействий (биосродства) типа фермент-ингибитор, антитело-антиген, агонист (антагонист)-клеточный рецептор, а также на основе полупроводниковых структур и мезоэлектрического эффекта. Последние два биодатчика дают возможность создавать сенсоры, чувствительные к газам, что имеет существенное значение для создания роботов, реагирующих на изменения внешних воздействий.
Технологические варианты реакторов с иммобилизованными ферментами весьма разнообразны — колонки, трубки, полые волокна и пр. С их помощью на практике определяют концентрацию широкого спектра соединений — глюкозы, аминокислот, мочевины, пенициллина, АТФ, НАДН, ФМН, стероидов, триглицеридов, желчных кислот и многих других (J.Aylott, R. Kopelman, 2000). Так, американскими исследователями сконструирован микродатчик на основе глюкозооксидазы и рутениевого красителя, иммобилизованных в полиакриламидной матрице с использованием субмикронных оптических волокон. Микробиосенсор, не вызывая повреждений, может быть введен в клетку и даже в отдельные ее компартменты для измерения содержания в них глюкозы и кислорода. Предложены датчики на базе иммунодетекции для проведения экспресс-анализов на присутствие производных диоксина (Nomuraet.al., 2000) и оценки содержания биогенных аминов (с помощью моноаминооксидазы) в пищевых продуктах в связи с процессами их старения. Для определения мочевины ферментным электродом требуется всего 30 с.
Биосенсоры на основе иммобилизованных ферментов помогают выполнять десятки быстрых и точных анализов при диагностике заболеваний, контролировать содержание вредных веществ (инсектицидов, пестицидов, удобрений) в пищевых продуктах и в воздухе. Биосенсоры нашли применение в решении аналитических задач в химической и микробиологической промышленности, а также в научных исследованиях.
6.6. Иммобилизованные ферменты в медицине
Иммобилизованные ферменты имеют огромное значение для медицины. В частности, большой рынок сбыта занимают тромболитические ферменты, предназначенные для борьбы с сердечнососудистыми заболеваниями. Так, в отечественную клиническую практику внедрен препарат «стрептодеказа», содержащий стрептокиназу — активатор предшественника протеиназы плазмина, предотвращающий образование тромба в кровеносной системе.
Ферменты, разрушающие некоторые незаменимые аминокислоты (например, аспарагиназа), используют для борьбы со злокачественным ростом опухолей. Протеолитические ферменты (трипсин, химотрипсин, субтилизин, коллагеназа), иммобилизованные на волокнистых материалах (целлюлоза, полиамидные волокна, декстран и др.), применяют для эффективного лечения ран, язв, ожогов, абсцессов, а их белковые ингибиторы — в заместительной терапии для лечения эмфиземы и панкреатитов.
Исключительно важны с практической точки зрения работы, посвященные направленному транспорту лекарственных веществ. В этом отношении особенно выгодны инкапсулированные ферменты типа искусственной клетки. Так, микрокапсулы, стенки которых представлены оболочкой эритроцита («тень эритроцита»), а их содержимое заполнено ферментом аспарагиназой, переносятся кровотоком к зонам скопления аспарагина и поэтому применяются для лечения аспарагинзависимых опухолей, в частности саркомы. Колонки, заполненные микрокапсулами с ферментом, используют для диализа в аппарате «искусственная почка», которая работает в 100 раз эффективнее обычного аппарата.
Применение иммобилизованных ферментов и белков в медицинеоткрывают новые перспективы создания эффективных лекарственныхсредств.
Ферменты, закрепленные на носителях или модифицированные полимерами,часто снижают свою антигенность из-за уменьшения доступности их длярецепторов иммунной системы. На принципах иммобилизации физиологическиактивных соединений базируется приготовление ферментных препаратов,обладающих повышенным терапевтическим эффектом.
Интересные возможности были обнаружены при использовании ферментовдля повышения чувствительности иммунохимических методов анализа. Сутьлюбого иммунохимического анализа в том, что после завершения реакцииантиген-антитело определить концентрацию избыточного компонента(антигена или антитела), не вступившего в реакцию. Поскольку этиконцентрации очень невысоки (10 -12 - 10 -8 моль/л), то для их обнаруженияобычно применяют легко детектируемую (определяемую) меткурадиоактивным атомом, вводимым в один из компонентов (радиоактивныйиод, тритий). Оказалось, что можно, без потери чувствительности метода,заменить радиоактивную метку на присоединение фермента, который можнообнаружить по его каталитической активности. Следовательно, с помощьюиммуноферментного анализа (ИФА) могут быть определены любые вещества,обладающие свойствами антигенов и, конечно, многочисленные возбудителизаболеваний человека, животных, растений.
Таким образом, использование иммобилизованных ферментов во многих жизненно важных отраслях народного хозяйства становится все более массовым. Выгодное сочетание избирательности и эффективности с долговечностью и стабильностью иммобилизованных ферментов в корне меняет химическое производство, способы добывания сырья, способствует созданию новых биотехнологических процессов и методов терапии, совершенствует медицинскую диагностику, анализ, органический синтез и оказывает огромное влияние на образ жизни человека.
Список использованной литературы:
1. Биотехнология. Ю.О. Сазыкин, С.Н. Орехов, И.И. Чакалева – М.: «Академия», 2007 г. – 215 с.
2. Егорова Т. А. Основы биотехнологии: Учеб. пособие для высш. пед. учеб заведений / Т.А.Егорова, С.М.Клунова, Е.А.Живухина. — М.: Издательский центр «Академия», 2003. — 208 с.
3. Катлинский А.В., Сазыкин Ю.О., Орехов С.Н., Чакалева И.И., Курс лекций по биотехнологии / ММА им. И.М. Сеченова, 2005 г. – 150 с.
4. Османов В.К., Лекции по биотехнологии/Ниж ГМА, 2008 г. – 250 с.
5. Основы фармацевтической биотехнологии, Т.П. Прищеп, В.С. Чучалин, К.Л. Зайков, Л.К. Михалева, Л.С. Белова – Ростов н/Д.: Феникс, 2006 г. – 180 с.
6. Тимощенко Л.В., Чубик М. В. Основы микробиологии и биотехнологии: учебное пособие /Л.В. Тимощенко, М.В. Чубик. – Томск: Изд-во Томского политехнического университета, 2009. – 194 с.
7. Фармацевтическая биотехнология: учеб. пособие / В.А. Быков (и другие) под общ. редакцией акад. РАМН и РАСНХ, профессора В.А. Быкова – Воронеж: издательство Воронеж. гос. ун-та, 2009. – 439 с.
Интернет ресурсы:
8. www.biotechnolog.ru
9. Биотехнология: генная инженерия, промышленная биотехнология, клеточная инженерия – учебное пособие: [электронный ресурс]. – Режим доступа: http://www. biotechnolog.ru
10. Биоинформатика, геномика, протеомика. биософт, имейджинг: [Электронный ресурс]. – Режим доступа: http://www.bioinFormatix.ru
11. Интернет журнал «Коммерческая биотехнология»: [Электронный ресурс]. – Режим доступа: http://www.cbio.ru
12. Общество биотехнологов России им. Ю.А. Овчинникова: [Электронный ресурс]. – Режим доступа: http://www.biorosinfo.ru Remedium.ru:
13. Профессионально о медицине и фармации [Электронный ресурс]. – Режим доступа: http://www.remedium.ru
14. Новости GMP – Стандарт GMP – Фармацевтические производства и технологии [Электронный ресурс]. – Режим доступа http://www.gmpnews.ru
15. Ассоциация Российских фармацевтических производителей [Электронный ресурс]. – Режим доступа http://www.arfp.ru
Федеральное государственное бюджетное образовательное учреждение высшего образования «Северо-Осетинская государственная медицинская академия» Министерства здравоохранения Российской Федерации
Лекция №9
Тема лекции:Нормофлоры и пробиотики. Препараты на основе живых культур микроорганизмов.
Ф.И.О. ассистента: Караева А.М.
по предметубиотехнология
факультет фармация
курс IV, VIII семестр
Лекция №9
Тема лекции:Нормофлоры и пробиотики. Препараты на основе живых культур микроорганизмов.
Цель лекции:ознакомить студентов с характеристикой номофлоры человека. Изучить пробиотики, как лекарственные препараты для коррекции микробиоценоза, а также их производство. Понять различие между пробиотиками и пребиотиками на примере лекарственных препаратов.
План лекции:
1. Характеристика нормофлоры человека
2. Лекарственные препараты для коррекции микробиоценоза
3. Эубиотики для профилактики и лечения заболеваний
4. Официально зарегистрированные биологические лекарственные препараты (пробиотики, пребиотики)
5. Пребиотики. Фрукто-олигосахариды (ФОС)
6. Производство препаратов нормофлоры
Оснащение лекции: презентация
Место проведения: аудитория 525
Дата добавления: 2018-04-15; просмотров: 791; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

