Факторы, влияющие на устойчивость образующихся комплексов в процессе титрования.
Устойчивость комплекса определяется величиной константы равновесия его образования. На языке термодинамики константа равновесия реакции является мерой выделившейся в реакции теплоты и изменения энтропии при реакции. Большее количество выделившейся теплоты приводит к образованию более устойчивых продуктов реакции. Энтропия системы является мерой беспорядка; больший беспорядок относительно исходных веществ, обусловленный образованием продуктов реакции, приводит к увеличению энтропии при реакции и к большей устойчивости конечных продуктов.

Условия, для проведения комплексонометрического анализа. Способы осуществления титрования.
Условия применения:
1. высокая скорость
2. реакция проходит количественно,стехиометрично, до конца.
3. есть индикатор
4. можно титровать смесь катионов, оттитровывая последовательно каждый катион, если разность логарифмов условных констант отличаются больше чем на 4 единицы.
Комплексонами называют органические вещества, которые содержат одну или несколько аминодикарбоксильных групп – N(CH2COOH)2.
Комплексоны вступают в реакции с катионами многих металлов в соотношении 1:1, образуя растворимые в воде комплексы. Комплексонометрическое титрование разрешает сократить время анализа и является очень простым и точным. В государственной фармакопее есть раздел комплексонометрии.
Комплексон ІІ: этилендиаминтетраацетатная кислота (ЭДТАК)
ЭДТА – белое кристиллическое вещество, малорастворимое в воде (то есть 7* 10-3 моль/л). Вследствие низкой растворимости сама кислота не подходит для приготовления титранта. Для этой цели применяют ее динатриевую соль, которую получают добавлением к раствору кислоты гидроксида натрия до рН~5:
H4Y + 2NaOH = 2H2O + Na2H2Y.
Комплексон ІІІ: этилендиаминтетраацетат натрия (Na-ЕДТА, трилон Б, хелатон) - Na2H2Y
Динатриевая соль кристаллизуется с двумя молекулами воды: Na2H2Y*2H2O. Эта соль относительно хорошо растворима в воде. Динатриевую соль этилен-диаминтетраацетатной кислоты называют также комплексом ІІІ или трилоном Б.
Титрование раствором этой соли сейчас выполняют большинство комплексонометрических определений.
Трилонометрия. Титрант – динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА) или трилон Б.
Обоснование Метод основан на свойстве ионов металлов (1+ до 4+) образовывать с трилоном Б бесцветные, прочные, растворимые внутрикомплексные соединения в мольном отношении 1:1.
Титрант – трилон Б
(динатриевая соль этилендиаминтетрауксусной кислоты – ЭДТА)
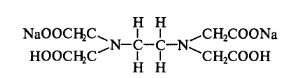
Трилон Б имеет в структуре карбоксильные группы и 2 атома азота с неподвижной парой атомов. Ионы металлов образуют соли, замещая атомы водорода карбоксильных групп и одновременно связываясь координационно с атомами азота.
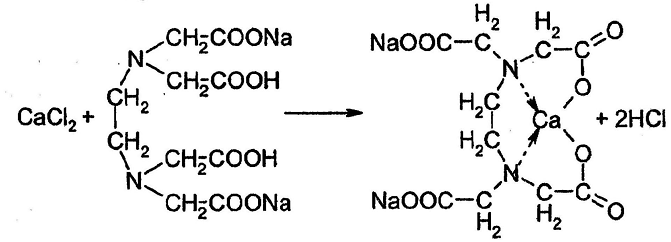
Прочность комплексов характеризуется величиной константы нестойкости (Кнест), которая указывает на способность комплекса к диссоциации. Чем больше значение Кнест, тем менее прочен комплекс, тем больше он диссоциирует с образованием исходных катиона и аниона.
Прочность комплекса Ме-ТрБ возрастает в ряду:
Mg→ Ba→ Ca→ Zn→ Al→ Cu→ Pb→ Bi
Значение констант нестойкости следует учитывать при выборе индикатора: комплекс иона металла с индикатором должен быть менее прочным, чем комплекс того же иона с трилоном Б.
Дата добавления: 2018-04-15; просмотров: 480; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
