Модуль I. 8. Титрование сильных кислот (сильных оснований) сильными основаниями (сильными кислотами).
Принцип построения кривых, изображающих ход изменения рН в процессе нейтрализации.В ходе нейтрализации рН титруемого раствора меняется в зависимости от объема прибавленного стандартного раствора (VВ) и от его титра (ТВ). Следовательно, если на оси абсцисс откладывать процентное содержание остающейся в растворе в разные моменты титрования кислоты или щелочи или количество прибавленного стандартного раствора в миллилитрах, а на оси ординат—отвечающие им значения рН раствора, то получается ряд точек, соединив которые, можно представить ход изменения рН в процессе нейтрализации. Кривые титрования различных кислот и оснований представлены на рис. 2.1.-2.7.
Процесс нейтрализации можно представить графически в виде кривой титрования, изображающей изменение рН титруемого раствора по мере приливания к нему стандартного (титрованного) раствора кислоты или щелочи.
Построение кривой титрования ведут с таким расчетом, чтобы показать значения рН раствора, соответствующие главнейшим моментам титрования.
Значения рН растворов, соответствующие различным моментам титрования, вычисляют по формулам, выражающим значения концентраций ионов водорода в воде, в водных растворах кислот, оснований, гидролизующихся солей и, наконец, в буферных смесях.
Значение кривых нейтрализации. Кривые титрования дают возможность проследить изменение рН раствора в различные моменты титрования, изучить влияние температуры и концентрации реагирующих веществ на процесс нейтрализации, установить конец титрования и, как будет показано в дальнейшем, сделать правильный выбор индикатора.
|
|
|
9. Расчет кривых титрования рН = f (Vт или τ).
Вычисления рН раствора в различные моменты титрования кислоты сильным основанием.
Предположит, что для титрования взято 100 мл 0,1 н. раствора НС1, который титруется 0,1 н. раствором NaOH.
Концентрация ионов водорода в предельно разбавленных растворах водных растворах сильных кислот (типа НСl) практически равняется концентрации этих кислот.
[H+] » CHAn
pH = - lg[H+]= -lgCHAn
Концентрация ионов гидроксила в предельно разбавленных растворах сильных оснований (типа NaОН) практически равняется концентрации этих оснований.
[OH⁻] »CKtOH
pOH = - lg[OH⁻] = -lgCKtOH
pH = 14-pOH = 14 + lgCKtOH
Рассмотрим, что произойдет с 0,1 н. раствором НС1, если прилить к нему 50; 90; 99, 99,9 мл 0,1 н. раствора NaOH. При приливании 50 мл 0,1 н. раствора NaOH останется не нейтрализованным 50% НС1; при приливании 90 мл NaOH—10% НС1; 99 мл NaOH—1% НС1; 99,9 мл NaOH—0,1% НС1.
Тогда, соответственно прибавленному количеству NaOH, объем титруемого раствора увеличится при прибавлении 50 мл NaOH до 150 мл; 90 мл NaOH до 190 мл, 99 мл NaOH до 199 мл и 99,9 мл NaOH до 199,9 мл. Изменятся также концентрация ионов водорода и рН раствора.
|
|
|
Титрование слабых кислот или оснований.
При титровании разбавленных растворов кислот более слабых, чем уксусная, скачок титрования еще меньше. Определение точки эквивалентности при титровании таких кислот с помощью индикаторов весьма затруднительно и во многих случаях просто невозможно. Для количественного определения очень слабых кислот прибегают к специальным методам титрования и используют для этой цели неводные среды. Для вычисления рН раствора вблизи точки эквивалентности при титровании очень слабых кислот пользуются более сложными уравнениями.
Вычисление рН раствора в различные моменты титрования кислоты щелочью. Предположим, что для титрования взято 100 мл 0,1 н. раствора СН3СООН, титруемого 0,1 н. раствором NaOH.
В данном случае концентрацию ионов водорода слабой кислоты нельзя приравнять концентрации СН3СООН. Поэтому для вычисления рН растворов в нулевой точке (до начала титрования) применяют выведенные ранее формулы для вычисления концентрации ионов водорода в растворах слабых кислот:
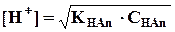 (1)
(1)
откуда
рН = -lg[H+] = - 1/2 lgKHAn - 1/2 lgCHAn (2)
или
рН = 1/2 рKHAn - 1/2 lgCHAn (3), а конкретно
|
|
|
рН = 1/2 рKCHзCOOH - 1/2 lgCCHзCOOH
KCHзCOOH = 1,82×10-5
pKCHзCOOH = -lgKCHзCOOH = 5 -lg 1,82 = 5- 0,26 = 4,74
Подставляя соответствующие значения pKCHзCOOH, lgKCHзCOOH и lgKCHзCOONa в формулу (2), получим:
рН = 1/2 х 4,74 + 1/2 х lg 0,1 = 2,37 + 0,50 = 2,87
Таким образом, величина рН 0,1 н. раствора СН3СООН равняется 2,87.
Титрование смесей веществ.
Кривая титрования смеси имеет два излома, соответствующих нейтрализации сильной и слабой кислот.Кривая титрования смеси имеет только два излома, соответствующих титрованию избытка сильного основания и основных групп в анионах амфолита. После второй точки эквивалентности происходит нелинейное увеличение электропроводности раствора.
Кривая титрования смеси имеет три излома, соответствующих нейтрализации свободного сильного основания, вытеснению слабых кислотных групп амфолита и нейтрализации основных групп амфолита. При избытке сильного основания электропроводность резко увеличивается. Кривая титрования позволяет проводить раздельное определение компонентов смеси.
Крика титрования смесей этих кислот в среде метилбутилкетопа( кривая, ), помимо двух скачкен. Третий скачок является результатом образования в процессе титрования осадка перхлората те траэтиламмопия, плохо растворимого в метилбутнлкетоие и бензоле, накапливающемся в процессе титрования бензолыш-мстанолоным раствором титрапта
Дата добавления: 2018-04-15; просмотров: 479; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
