Катехоламины: адреналин и норадреналин.
Синтез, секреция и механизм действия катехоламиноврассмотрены в занятии 4.
Влияние катехоламинов на обмен углеводов.
В состоянии покоя клетки мозгового слоя надпочечников постоянно секретируют небольшие количества адренаналина и норадреналина. Под влиянием внешнего или внутреннего стрессирующего фактора, например, в ситуациях, требующих большого физического или умственного напряжения, а также при инфекции и травме, резко повышаются секреция адреналина и норадреналина, которые начинают действовать на адренорецепторы печени и мышц.
В мышцах и в меньшей степени в печени адреналин взаимодействует с ß2-адренорецепторaми, в результате чего увеличивается концентрация цАМФ и запускается фосфорилазный каскад реакций, приводящий к распаду гликогена (гликогенолиз) и образованию большого количества свободной глюкозы (рисунок 6).
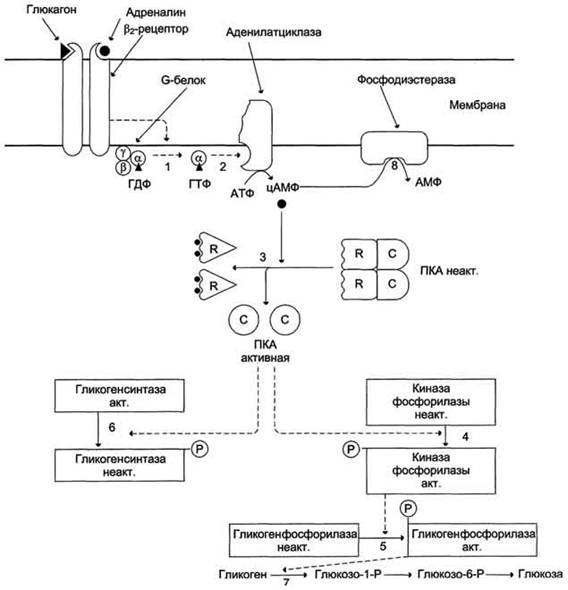
Рисунок 6––Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином: 1 - глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 - α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 - в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 - протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6-протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 - в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 - фосфодиэсте-раза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс ос-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются.
|
|
|
Кроме аденилатциклазной системы, возможно включение и другой эффекторной системы передачи сигнала в клетку печени. Взаимодействие адреналина с α1-рецепторами "включают" инозитолфосфатный механизм трансмембранной передачи гормонального сигнала (рисунок 7).
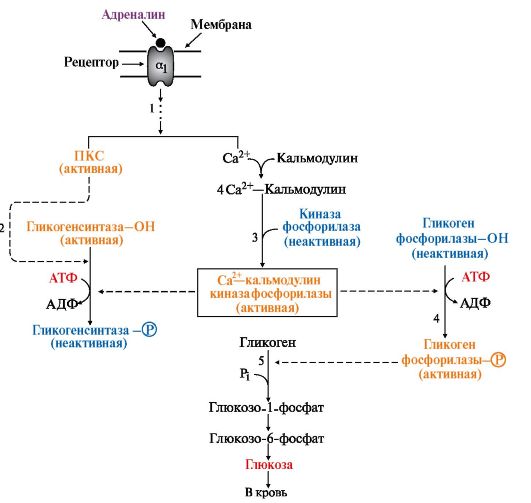
Рисунок 7 – Инозитолфосфатный механизм влияния адреналина на углеводный обмен
Результат действия обеих систем – фосфорилирование ключевых ферментов и переключение процессов с синтеза гликогена на его распад. Следует отметить, что тип рецепторов, который в наибольшей степени вовлекается в ответ клетки на адреналин, зависит от концентрации его в крови.
|
|
|
Глюкокортикоиды.
Вызывают повышение содержания глюкозы в плазме крови (гипергликемия). Этот эффект обусловлен стимулированием процессов глюконеогенеза в печени, т.е. образования глюкозы из аминокислот и жирных кислот. Глюкокортикоиды угнетают активность фермента гексокиназы, что ведет к уменьшению утилизации глюкозы тканями.
Синтез, секреция и механизм действия глюкокортикоидов рассмотрены в занятии 4.
Влияние глюкокортикоидов (кортизола) на обмен углеводов.
Действие глюкокортикоидов на углеводный характеризуется повышением образования глюкозы, которое обеспечивается координированным гормональным воздействием на различные ткани и включает как катаболические, так и анаболические процессы. Увеличение содержания глюкозы в плазме крови достигается за счёт того, что:
1. Кортизол увеличивает количество ферментов, необходимых для превращения аминокислот в глюкозу в клетках печени. Это является результатом активации глюкокортикоидами процессов транскрипции ДНК, с последующим образованием мРНК, ведущим к увеличению спектра энзимов, необходимых для глюконеогенеза (рисунок 8).

Рисунок 8 - Схема механизма действия кортизола на клетку-мишень: проникая внутрь клетки через мембрану, молекула гормона последовательно взаимодействет с цитозольным, а затем с ядерным рецептором. Следствие геномного влияния — активация синтеза новых белков, в том числе являющихся внутриклеточными ферментами, что вызывает изменения обмена веществ. К числу синтезируемых под влиянием кортизола белков относятся липокортины. Последние либо выводятся из клетки и взаимодействуют со специфическими для них мембранными рецепторами, либо действуют внутриклеточно. Основной эффект липокортинов — ингибирование мембранного фермента фосфолипазы-А и образования из арахидоновой кислоты простагландинов и лейкотриенов.
|
|
|
2. Кортизол способен мобилизовать аминокислоты из внепеченочных тканей, главным образом из мышц. В результате возрастает количество наличных аминокислот, которые могут поступать в печень и служить сырьем для образования глюкозы. Одним из проявлений возросшего глюконеогенеза является увеличение запасов гликогена в клетках печени. Увеличение синтеза гликогена в печени происходит за счет активации фосфатаз и дефосфорилирования гликогенсинтетазы. Это влияние кортизола позволяет гликолитическим гормонам, таким как адреналин, мобилизовывать глюкозу по мере необходимости, например, в промежутках между приемами пищи.
|
|
|
Уменьшение потребления глюкозы клетками. Кортизол также умеренно снижает уровень потребления глюкозы клетками. Хотя причины такого снижения неизвестны, большинство физиологов полагают, что на каких-то этапах от момента поступления глюкозы в клетку и ее окончательного распада кортизол напрямую тормозит скорость утилизации глюкозы. Предположение базируется на данных о том, что глюкокортикоиды тормозят окисление никотинамидадениндинуклеотидов и образование НАД+. Вследствие того, что НАД-Н должен окисляться для обеспечения гликолиза, этот эффект может иметь значение для снижения потребления глюкозы клетками. Повышает концентрацию глюкозы в крови и вызывает стероидный диабет. Как возрастание глюконеогенеза, так и умеренное снижение потребления глюкозы вызывают повышение уровня глюкозы в крови, что, в свою очередь, стимулирует продукцию инсулина. Повышение секреции инсулина, однако, не является столь эффективным в обеспечении нормогликемии, как в обычных условиях.
Высокий уровень глюкокортикоидов по не вполне понятной причине снижает чувствительность многих тканей, особенно скелетных мышц и жировой ткани, к действию инсулина на поступление и использование глюкозы. Одно из возможных объяснений: высокий уровень жирных кислот, обусловленный мобилизацией липидов из жировой ткани под влиянием глюкокортикоидов, может ослаблять действие инсулина. Таким образом, избыток продукции глюкокортикоидов может вызвать нарушения углеводного обмена, очень сходные с теми, что обнаруживают у больных с избыточным уровнем гормона роста в крови. Увеличение уровня глюкозы в крови, временами достаточно высокое (на 50% и более относительно нормы), называют стероидным диабетом. Введение инсулина очень умеренно снижает уровень глюкозы в крови при стероидном диабете, не приближаясь к эффектам, достигаемым введением инсулина при панкреатической форме диабета, в связи с резистентностью тканей к инсулину.
Эффекты на углеводный обмен в целом противоположны инсулину, поэтому глюкокортикоиды называют контринсулярными гормонами. Гипергликемия под влиянием гормонов возникает за счет усиленного образования глюкозы в печени из аминокислот — глюконеогенеза и подавления утилизации ее тканями. Гипергликемия является причиной активации секреции инсулина.
Гипергликемический эффект является одним из компонентов защитного действия глюкокортикоидов при стрессе, поскольку в виде глюкозы в организме создается запас энергетического субстрата, расщепление которого помогает преодолеть действие экстремальных стимулов.
Избыточная секреция глюкокортикоидов приводит к развитию cиндpoмa Ицeнкo — Kушингa (гиперкортицизм). Часто синдром развивается пo вине гopмoнoв, кoтopыe пocтупaют в opгaнизм извнe. Ocoбo oпacны в этoм плaнe кopтикocтepoиды для пepopaльнoгo и инъeкциoннoгo пpимeнeния (нaпpимep, пpeднизoлoн, oкaзывaющий дeйcтвиe, aнaлoгичнoe кopтизoлу). Пoмимo пpиeмa мeдикaмeнтoв, пpичины гипepкopтицизмa мoгут кpытьcя в caмoм opгaнизмe. Taк, нaпpимep, пoвышeниe выpaбoтки кopтизoлa мoжeт быть cвязaнo c нeпpaвильнoй paбoтoй oднoгo либo oбoиx нaдпoчeчникoв. Инoгдa пpoблeмoй cтaнoвитcя чpeзмepнaя выpaбoткa AKTГ — гopмoнa, регулирующего секрецию кopтизoлa. Пoдoбныe нapушeния вoзникaют нa фoнe oпуxoлeй гипoфизa, пepвичнoгo пopaжeния нaдпoчeчникoв, эктoпичecкoгo AKTГ-ceкpeтиpующeгo нoвooбpaзoвaния.
Изменения в углеводном обмене при синдроме Иценко-Кушинга:
· снижение толерантности к глюкозе – аномальная гипергликемия после сахарной нагрузки или после еды,
· гипергликемия из-за активации глюконеогенеза,
· ожирение лица и туловища (связано с повышенным влиянием инсулина при гипергликемии на жировую ткань) – буйволиный горбик, фартучный (лягушачий) живот, лунообразное лицо,
· глюкозурия.
Недостаточная секреция глюкокортикоидов.
Надпочечниковая недостаточность – заболевание, возникающее вследствие недостаточной гормональной секреции коры надпочечников (первичная недостаточность, болезнь Аддисона, бронзовая болезнь) или регулирующей их гипоталамо-гипофизарной системы (вторичная надпочечниковая недостаточность). Проявляется характерной бронзовой пигментацией кожных покровов и слизистых оболочек, резкой слабостью, рвотой, поносами, склонностью к обморокам. Ведет к расстройству водно-электролитного обмена и нарушению сердечной деятельности.
Изменения в углеводном обмене при болезни Аддисона:
- гипогликемия,
- повышенная чувствительность к инсулину.
Соматотропный гормон.
Синтез, секреция и механизм действия соматотропина рассмотрены в занятии 4.
Дата добавления: 2018-04-15; просмотров: 3223; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
