Распределение белков-транспортеров глюкозы (ГЛЮТ)
| Тип ГЛЮТ | Локализация в органах |
| ГЛЮТ-1 | преимущественно в плаценте, мозге, почках, толстой кишке, меньше в жировой ткани, мышцах |
| ГЛЮТ-2 | преимущественно в печени, β-клетках островков Лангерганса, энтероцитах |
| ГЛЮТ-3 | во многих тканях, включая мозг, плаценту, почки |
| ГЛЮТ-4 | инсулинозависимый, в мышцах (скелетных, сердечной), жировой ткани (находятся почти полностью в цитоплазме) |
| ГЛЮТ-5 | в тонкой кишке, в меньшей мере в почках, скелетных мышцах, жировой ткани, мозге. Переносчик фруктозы |
Все типы ГЛЮТ могут находиться как в плазматической мембране, так и в цитозольных везикулах. В клетках мышц и жировой ткани ГЛЮТ-4 (инсулинозависимые) почти полностью локализуются в цитоплазме. Влияние инсулина на такие клетки приводит к перемещению везикул, содержащих ГЛЮТ-4, к плазматической мембране и их слиянию с ней. После этого возможен облегченный транспорт глюкозы в клетки. При снижении концентрации инсулина в крови белки транспортеры глюкозы снова перемещаются в цитозоль и поступление глюкозы в эти ткани прекращается.
Гипо - и гипергликимии. Сахарный диабет.
В случае секреции слишком большого количества инсулина (например, при опухоли β-клеток - инсулиноме) или при передозировке экзогенно введенного инсулина, уровень глюкозы в крови падает, и может наступить гипогликемическая кома, которая может закончиться летально, если вовремя не будет оказана медицинская помощь.
|
|
|
Если инсулина вырабатывается слишком мало или он не может действовать на клетки-мишени, устанавливается высокий уровень сахара в крови (гипергликемия), и развивается сахарный диабет. Название этого заболевания Diabetus mellitus (diabetus — просеиваю, mellitus — сладкий) связано с тем, что моча становится сладкая на вкус, вследствие глюкозурии. При дефиците инсулина нарушаются все виды пластического, энергетического, водно-солевого обмена, страдают практически все функциональные системы.
Классификация сахарного диабета (1999 год)
1. Сахарный диабет типа I — деструкция ß-клеток, обычно приводящая к абсолютной инсулиновой недостаточности.
· Иммунно-опосредованный диабет (АДА) и аутоиммунный (ВОЗ)
· Идиопатический
2. Сахарный диабет типа II — от преимущественной резистентности с относительной или умеренной инсулиновой недостаточностью до преимущественного дефекта секреции инсулина с резистентностью к нему (АДА) или от преимущественной резистентности к инсулину с относительной инсулиновой недостаточностью до преимущественного секреторного дефекта с/или без инсулиновой резистентности (ВОЗ).
3. Другие специфические типы диабета:
|
|
|
· Генетические дефекты β-клеток (АДА),
· Генетические дефекты β-клеточной функции (ВОЗ)
· Генетические дефекты действия инсулина
· Болезни экзокринной части поджелудочной железы
· Эндокринопатии
· Диабет, индуцированный лекарствами или химическими веществами
· Диабет, вызванный инфекциями
· Необычные формы иммунно-опосредованного диабета
· Другие генетические синдромы, сочетающиеся с диабетом
4. Гестационный сахарный диабет (диабет беременных).
Инсулинзависимый сахарный диабет
Инсулинзависимый сахарный диабет (ИЗСД) — заболевание, вызываемое разрушением β -клеток островков Лангерганса поджелудочной железы.
Деструкция β-клеток — результат аутоиммунных реакций. В аутоиммунной реакции принимают участие лимфоциты и макрофаги (моноциты). Эти клетки продуцируют цитокины, которые либо непосредственно повреждают β-клетки, либо опосредуют клеточные реакции против β-клеток.
Провоцировать возникновение диабета I типа может вирусная инфекция, вызывающая деструкцию β-клеток. К таким вирусам, называемым β-цитотропными, относят вирусы оспы, краснухи, кори, цитомегаловирус, эпидемического паротита, Коксаки, аденовирус. Некоторые β-цитотропные вирусы вызывают лизис β-клеток.
|
|
|
Известны некоторые токсические вещества, например, производные нитрозомочевины и другие нитро- или аминосодержащие соединения, избирательно поражающие β-клетки и индуцирующие аутоиммунную реакцию. Кроме того, ИЗСД может быть результатом частичного генетически обусловленного дефекта системы иммунологического надзора и сочетаться с другими аутоиммунными заболеваниями. На долю ИЗСД приходится примерно 25-30% всех случаев сахарного диабета. Как правило, разрушение β-клеток происходит медленно, и начало заболевания не сопровождается нарушениями метаболизма. Когда погибает 80-95% клеток, возникает абсолютный дефицит инсулина, и развиваются тяжёлые метаболические нарушения. ИЗСД поражает в большинстве случаев детей, подростков и молодых людей, но может проявиться в любом возрасте (начиная с годовалого).
2. Инсулинонезависимый сахарный диабет
Инсулинонезависимый сахарный диабет (ИНСД) — общее название нескольких заболеваний, развивающихся в результате относительного дефицита инсулина, возникающего вследствие нарушения секреции инсулина, нарушения превращения проинсулина в инсулин, повышения скорости катаболизма инсулина, а также повреждения механизмов передачи инсулинового сигнала в клетки-мишени (например, дефекта рецептора инсулина, повреждения внутриклеточных посредников инсулинового сигнала и др.). ИНСД поражает людей, как правило, старше 40 лет. Сахарный диабет II типа характеризуется высокой частотой семейных форм. Риск ИНСД у ближайших родственников больного достигает 50%, тогда как при ИЗСД он не превышает 10%. Заболевание поражает преимущественно жителей развитых стран, особенно горожан.
|
|
|
Возможными причинами ИНСД могут быть: образование антител к рецепторам инсулина; генетический дефект пострецепторного аппарата инсулинзависимых тканей; нарушения регуляции секреции инсулина.
К факторам, определяющим развитие и клиническое течение болезни, относят ожирение, неправильный режим питания, малоподвижный образ жизни, стресс.
Мутации генов, контролирующих секрецию инсулина, энергетический обмен в β-клетках и обмен глюкозы в клетках-мишенях инсулина, приводят к возникновению нескольких форм ИНСД с аутосомно-доминантным наследованием.
Основным провоцирующим фактором инсулинонезависимого диабета служит ожирение.
Этот тип диабета часто сочетается с гиперинсулинемией, что способствует ожирению. Таким образом, ожирение, с одной стороны, важнейший фактор риска, а с другой — одно из ранних проявлений сахарного диабета.
При сахарном диабете, как правило, соотношение инсулин/глюкагон снижено. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация запасов энергоносителей. Печень, мышцы и жировая ткань даже после приёма пищи функционируют в режиме постабсорбтивного состояния.
Симптомы сахарного диабета
Для всех форм диабета характерно повышение концентрации глюкозы в крови — гипергликемия.После приёма пищи концентрация глюкозы может достигать 300-500 мг/дл и сохраняется на высоком уровне в постабсорбтивном периоде, т.е. снижается толерантность к глюкозе.
Повышение концентрации глюкозы в плазме крови обусловлено снижением скорости использования глюкозы тканями вследствие недостатка инсулина или снижения биологического действия инсулина в тканях-мишенях.
При дефиците инсулина уменьшается количество белков-переносчиков глюкозы (ГЛЮТ-4) на мембранах инсулинзависимых клеток (жировой ткани и мышц). В мышцах и печени глюкоза не депонируется в виде гликогена, в жировой ткани уменьшается скорость синтеза и депонирования жиров. Кроме того, при снижении инсулинглюкагонового индекса активируется глюконеогенез из аминокислот, глицерола и лактата. Повышение концентрации глюкозы в крови при сахарном диабете превышает концентрационный почечный порог, что становится причиной выделения глюкозы с мочой (глюкозурия). В норме проксимальные канальцы почек реабсорбируют всю фильтрующуюся в клубочках глюкозу, если её уровень не превышает 8,9 ммоль/л (160 мг/дл).
К характерным признакам сахарного диабета относят также повышение концентрации в крови кетоновых тел - кетонемия.При низком соотношении инсулин/глюкагон жиры не депонируются, а ускоряется их катаболизм, так как гормончувствительная липаза в жировой ткани находится в фосфорилированной активной форме. Концентрация неэтерифицирован-ных жирных кислот в крови повышается. Печень захватывает жирные кислоты, окисляет их до ацетил-КоА, который, в свою очередь, превращается в β-гидроксимасляную и ацетоуксусную кислоты. В тканях ацетоацетат частично декарбоксилируется до ацетона, запах которого исходит от больных сахарным диабетом и ощущается даже на расстоянии. Увеличение концентрации кетоновых тел в крови (выше 20 мг/дл, иногда до 100 мг/дл) приводит к кетонурии. Накопление кетоновых тел снижает буферную ёмкость крови и вызывает ацидоз.
Ещё один характерный признак сахарного диабета — повышенный уровень в крови липопротеинов (в основном, ЛПОНП) — гиперлипопротеинемия. Пищевые жиры не депонируются в жировой ткани вследствие ослабления процессов запасания, а поступают в печень, где частично превращаются в триацилглицеролы, которые транспортируются из печени в составе ЛПОНП.
При сахарном диабете дефицит инсулина приводит к снижению скорости синтеза белков в организме и усилению распада белков. Это вызывает повышение концентрации аминокислот в крови. Аминокислоты поступают в печень и дезаминируются. Безазотистые остатки гликогенных аминокислот включаются в глюконеогенез, что ещё более усиливает гипергликемию. Образующийся при этом аммиак вступает в орнитиновый цикл, что приводит к увеличению концентрации мочевины в крови и, соответственно, в моче — азотемия и азотурия.
Высокие концентрации глюкозы, кетоновых тел, мочевины требуют усиленной экскреции их из организма. Поскольку концентрационная способность почек ограничена, резко увеличивается выделение большого количества воды, в результате чего может наступить обезвоживание организма. Выделение мочи у больных возрастает в несколько раз и в некоторых случаях достигает 8-9 л в сутки, но чаще не превышает 3-4 л — полиурия.Потеря воды вызывает постоянную жажду — полидипсия.
Нарушения углеводного обмена при сахарном диабете связаны с тем, что снижается поступление глюкозы в клетки из крови и все пути её использования (рисунки 3-4). Снижается гликолиз, окисление глюкозы, синтез гликогена, пентозофосфатный путь, синтез жиров из глюкозы. Наоборот, увеличивается мобилизация гликогена, глюконеогенез. Это вызывает гипергликемию – глюкозы много в крови и мало в тканях (“голод среди изобилия”). Из-за нарушения пентозо-фосфатного пути возникает дефицит НАДФН. Это способствует помутнению хрусталика (катаракта).
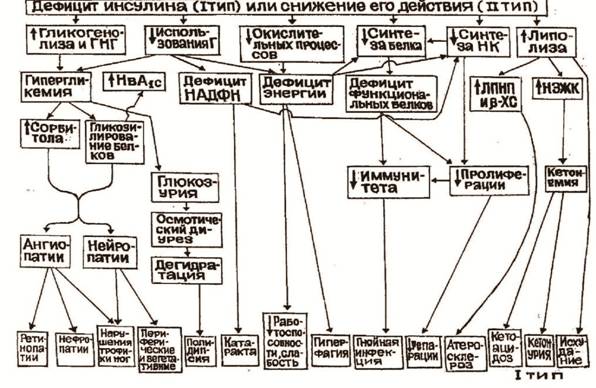
Рисунок 3 — Патогенез основных симптомов СД
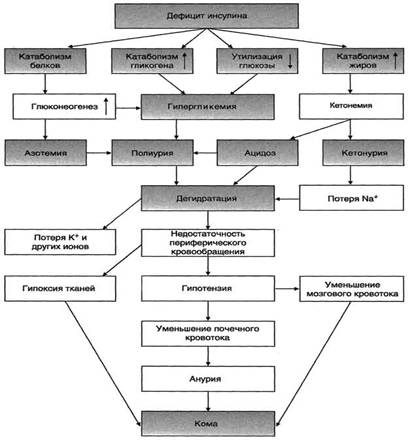
Рисунок 4— Изменение метаболизма при сахарном диабете
Глюкагон.
Глюкагон, образующийся в α-клетках островков Лангерганса представляет собой полипептид, состоящий из 29 аминокислотных остатков.
Синтез и секреция. Гормон синтезируется в α-клетках поджелудочной железы в виде неактивного предшественника препроглюкагона, который после отщепления N-конечной сигнальной последовательности превращается в проглюкагон и затем после воздействия протеаз - на глюкагон. В плазме глюкагон находится в свободной форме, поэтому период его полужизни составляет около 5 минут. Секреция глюкагона стимулируется аминокислотами, гастрином, катехоламинами и подавляется глюкозой, инсулином, жирными кислотами и Ca2 +.
Механизм действия глюкагона.
Механизм действия глюкагона обусловлен его связыванием со специфическими глюкагоновыми рецепторами клеток печени (рисунок 5). Это приводит к повышению опосредованной G-белком активности аденилатциклазы и увеличению образования цАМФ. Результатом является усиление катаболизма депонированного в печени гликогена (гликогенолиза). Глюкагон для гепатоцитов служит внешним сигналом о необходимости выделения в кровь глюкозы за счёт распада гликогена (гликогенолиза) или синтеза глюкозы из других веществ — глюконеогенеза. Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ. Далее следует каскад реакций, приводящий в печени к активации гликогенфосфорилазы и ингибированию гликогенсинтазы. Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь.
Также повышение содержания цАМФ индуцирует синтез ферментов глюконеогенеза в печени, усиливает превращение аминокислот в глюкозу. Таким образом, центральный эффект глюкагона — гипергликемия — обеспечивается двумя механизмами: быстрым (гликогенолиз) и медленным (глюконеогенез).
Глюкагон активирует гликогенолиз только в печени, в отличие от адреналина, который стимулирует этот процесс и в мышцах, и в печени. Глюкагон практически не оказывает действия на гликоген скелетных мышц, по-видимому, из-за практически полного отсутствия в них глюкагоновых рецепторов.

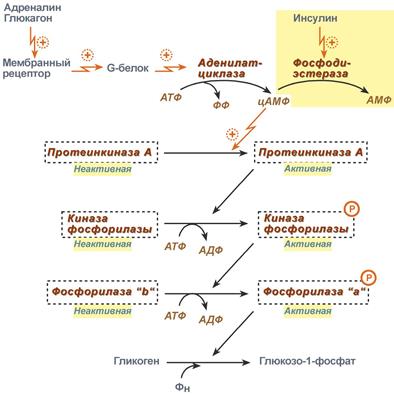
Рисунок 5 – Механизм действия глюкагона на клетку-мишень
Глюкагон вызывает увеличение секреции инсулина из здоровых β-клеток поджелудочной железы и торможение активности инсулиназы. Это является одним из физиологических механизмов противодействия вызываемой глюкагоном гипергликемии.
Таким образом биологическое действие глюкагона на углеводный обмен происходит в двух направлениях: активное участие в процессе гликогенолиза и стимуляция секреции инсулина.
Дата добавления: 2018-04-15; просмотров: 2161; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
