Различия белков по форме молекул
Как уже говорилось выше, по форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
Различия белков по молекулярной массе
Белки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).
Суммарный заряд белков
Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apr и Гис.
Степень ионизации функциональных групп этих радикалов зависит от рН среды. При рН раствора около 7 все ионогенные группы белка находятся в ионизированном состоянии. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. В щелочной среде связывание избытка ОН" с протонами, образующимися при диссоциации NH3+с образованием воды, приводит к уменьшению положительного заряда белков:
|
|
|
-NH3+ +ОН- → -NH2 + H2O.
Значение рН, при котором белок приобретает суммарный нулевой заряд, называют "изоэлектрическая точка"и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии.
Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина.
Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (- ). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.
|
|
|
4. Соотношение полярных и неполярных
групп на поверхности нативных молекул
белков
На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.
Растворимость белков
Растворимость белков в воде зависит от всех перечисленных выше свойств белков: формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать вьшадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
|
|
|
Факторы, определяющие стабильность белковых растворов:
· наличие зарядов в белковой молекуле. Одноименные заряды способствуют растворимости белка, т.к. препятствуют соединению молекул и выпадению в осадок.
· Наличие гидратной оболочки, препятствующей объединению белковых молекул.
Для осаждения белка, его необходимо лишить этих двух факторов устойчивости. Методом осаждения белка является высаливание - осаждение белка с помощью нейтральных солей.
В полунасыщенном растворе (NH4)2-SO4 осаждаются глобулины, а в насыщенном - альбумины.
После удаления осаждающего фактора, белки переходят в растворённое состояние.
Задание 2.
Количество фермента в клетке зависит от скорости его синтеза и распада, процессов необходимых для обновления фермента. Синтез и распад ферментов регулируется независимо. Наиболее изучен механизм регуляции синтеза ферментов на уровне транскрипции, который осуществляется определенными метаболитами, гормонами и рядом биологически активных веществ.
|
|
|
Индукция– запуск синтеза ферментов под действием специфических низкомолекулярных соединений –индукторов. Например, у бактерий ферменты синтезируются только при наличии для них субстратов, которые являются для этих ферментов индукторами (уE.coliлактоза индуктор β-галактозидазы).
Индуцируемые ферменты– ферменты, концентрация, которых зависит от добавления индукторов (органоспецифические ферменты).
Конститутивные ферменты– ферменты, концентрация которых постоянна и не регулируется индукторами (ферменты гликолиза, синтеза РНК и т.д.).
Базовый уровень– концентрация фермента при отсутствии индуктора. При индукции базовый уровень фермента может быть превышен от 2 до 1000 раз.
Репрессия– остановка синтеза фермента под действием репрессора(точнее корепрессора).
Дерепрессия– возобновление синтеза ферментов или после удаления из среды репрессора или при истощении его запасов.
Часто один индуктор или репрессор регулируют синтез сразу нескольких ферментов участвующих в одном метаболическом пути. Гены этих ферментов собраны в оперон.
Оперон– участок молекулы ДНК, который содержит информацию о группе функционально взаимосвязанных структурных генов и регуляторную зону,промотор, контролирующую транскрипцию этих генов. Индукция и репрессия синтеза ферментов оперона называется координированной.
Координированная индукция– все ферменты, кодируемые генами оперона, индуцируются одним индуктором.
Координированная репрессия– остановка синтеза ферментов оперона одним репрессором.
В промоторе оперона имеется участок оператор, необходимый для присоединения репрессора. Репрессор синтезируется с гена-регулятора.
1). Индукция оперона. Репрессор присоединяется к оператору и препятствует присоединению к промотору РНК-полимеразы – транскрипции мРНК нет. Индуктор, присоединяясь к репрессору, вызывает отделение последнего от оператора, РНК-полимераза присоединяется к промотору и начинается транскрипция мРНК с оперона. С этой мРНК синтезируются сразу несколько ферментов.
рисунок
2). Репрессия оперона. Репрессор не присоединяется к оператору самостоятельно. Присоединение к оператору репрессора происходит только в комплексе с корепрессором. Комплекс репрессор-корепрессор присоединяясь к оператору, препятствует присоединению РНК-полимеразы к промотору, что блокирует транскрипцию мРНК с оперона и синтез ферментов.
рисунок
Катаболическая репрессия– более выгодный субстрат окисления ингибирует ферменты окисления менее выгодного субстрата.
Распад ферментов идет под действием гидролитических ферментов, регуляция этого процесса мало изучена.
Задание 3.
Химическое строение и свойства. производные пиридина (пиридоксин, пиридоксаль, пиридоксамин), отличающихся друг от друга наличием спиртовой, альдегидной или аминогруппы. Пиридоксин хорошо растворяется в воде и этаноле, устойчив в кислой и щелочной средах, легко разрушается под действием света при рН=7,0.
Коферментные функции выполняют 2 фосфорилированных производных пиридоксина: придоксальфосфат и пиридоксаминфосфат.
Биохимические функции:
А) Коферментные формы витамина В6 входят в состав следующих ферментов:
1. аминотрансфераз АК, катализирующих переаминирование
2. декарбоксилаз АК (образование биогенных аминов — гистамина, серотонина, ГАМК), а также моноаминоксидаз, гистаминазы (диаминооксидаза) и аминотрансферазы ГАМК, обезвреживающих (окисляющих) биогенные амины
3. изомераз АК (превращает D-АК в L-АК)
4. аминотрансферазиодтирозинов и иодтиронинов, участвующих в синтезе гормонов щитовидной железы и распаде этих гормонов в периферических тканях
5. синтазы ?–аминолевуленовой кислоты, участвующей в биосинтезе гема гемоглобина и других гем-содержащих белков (из глицина и сукцинил~ КоА)
6. кинурениназы и кинуренинаминотрансферазы, обеспечивающих синтез витамина РР из триптофана
7. цистатионинсинтазы и цистатионинлиазы – ферментов, катализирующих синтез и распад цистатионина
8. синтетазы 3-кетодигидросфингозида, участвующей в реакциях биосинтеза сфинголипидов (из серина и пальмитил~ КоА)
Б) участвует в процессе активного транспорта некоторых АК через клеточные мембраны
В) регулятор конформационного состояния гликогенфосфорилазы.
Гиповитаминоз.
Основные проявления: гипохромная анемия и судороги, сухой себорейный дерматит, стоматит и глоссит.
Чаще всего пиридоксиновая недостаточность наблюдается у маленьких детей при искусственном вскармливании стерилизованным молоком (разрушается витамин В6), у беременных при токсикозах, а также у взрослых при длительном лечении противотуберкулезным препаратом изониазидом (антагонист пиридоксаля).
Пищевые источники: бобовые, зерновые культуры, мясные продукты, рыба, картофель. Он синтезируется кишечной микрофлорой, частично покрывая потребность организма в этом витамине.
Суточная потребность: 2–2,2 мг пиридоксина.
Билет № 10
1. Ренактивация белка - восстановление исходной нативнойконформации белка( его структуры и билогической активности). Возможна, если не нарушена превичная структура белка.
Шаперо́ны — класс белков, главная функция которых состоит в восстановлении правильной нативной третичной или четвертичной структуры белков, а также образование и диссоциация белковых комплексов.
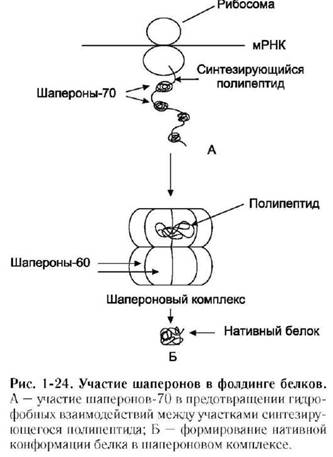
Функции:
· восстановлении правильной нативной третичной или четвертичной структуры белков,
· образование и диссоциация белковых комплексов.
· защита белков клетки от денатурации
Номенклатура.
Существует 2 типа названий
1.тривиальное (исторически закрепленное) – трипсин
2.систематическое. S+тип реакции+аза(окон)
Шифр фермента.
Классификация ферментов учитывает реакционную и субстратную специфичности ферментов, а не их белковую структуру. Шифр КФ определяет химическую реакцию, катализируемую ферментом.
"Правила номенклатуры ферментов", имеющие кодовое четырёхзначное цифровое обозначение, где первая цифра обозначает класс фермента, вторая цифра (подкласс) уточняет преобразуемую группировку, третья (подподкласс) - уточняетдополнительных участников реакции (например, донора и акцептора) и четвёртая - порядковый номер фермента в данной подгруппе.
*Согласно Международной классификации, ферменты делят на шесть главных классов, в каждом из которых несколько подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы)
3. Коферментная функция витаминов заключается в их вхождении в состав коферментов, необходимых для образования ферментов. Недостаточное поступление витаминов с пищей, нарушение их всасывания и усвоения, повышенная потребность организма в них могут приводить к специфическим для каждого витамина нарушениям обмена веществ и физиологических функций, снижению работоспособности. Длительный дефицит поступления витаминов вызывает специфические заболевания (гиповитаминозы и авитаминозы).
В9
Источники:Растительные продукты, дрожжи, мясо, печень, почки, желток яиц. Витамин активно синтезируется дружественной кишечной микрофлорой.
Суточная потребность: 400 мкг.
Строение
Витамин представляет собой комплекс из трех составляющих – птеридина, парааминобензойной кислоты и глутаминовой кислоты. Остатков глутамата, соединенных через γ-карбоксильную группу, может быть разное количество.
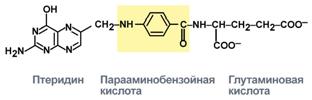
Строение фолиевой кислоты
Биохимические функции
Биохимические функции:
Коферментная форма фолиевой кислоты – ТГФК – необходима для мобилизации и использования в реакциях метаболизма одноуглеродных функциональных групп: метильной (- СН3), метиленовой (- СН2 -), метенильной (-СН =), формильной (– СНО) и формиминогруппы (СН=NH).
Важнейшими реакциями с участием одноуглеродных фрагментов, связанных с ТГФК, являются:
1) N5,N10-метенил-ТГФК и N10-формил ТГФК служат донорами соответствующих одноуглеродных радикалов при синтезе пуриновых нуклеотидов;
2) N5-метил-ТГФК вместе с витамином В12 участвуют в переносе метильной группы в реакциях синтеза дезокси-ТМФ и метионина;
3) ТГФК вовлекается в метаболизм аминокислот: серина, глицина и метионина.
Применение: используется для лечения анемии
Билет 12
1)После экстрагирования белков, т.е. перевода в растворенное состояние, приступают к разделению, фракционированию смеси белков на индивидуальные белки. Для этого применяют методы:
• высаливания;
• Определение белка в моче методом осаждения
• Реакции необратимого осаждения белков солями тяжелых металлов
• Диализ
Высаливание – обратимая реакция осаждения белков из растворов с помощью больших концентраций нейтральных солей: Nacl, (NH4)2SO4 и др. При высаливании происходит дегидратация макромолекул белка. На процесс высаливания влияет ряд факторов: молекулярная масса, заряд, гидрофильность белка, в связи с чем, для осаждения требуется различная концентрация одних и тех же солей. Глобулины, имеющие большую молекулярную массу, осаждаются в полунасыщенном растворе Nacl, а альбумины – в насыщенном. Высаливание белков является обратимой реакцией, т.к. осадок белка может вновь растворяться после удаления Nacl, например, с помощью диализа.
Дата добавления: 2018-04-04; просмотров: 1571; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
