Строение ДЭС на границе раствор-металл
Двойной электрический слой создается электрическими зарядами, находящимися на металле ионами противоположного заряда (противоионами), ориентированными у поверхности электрода.
Формулирование ионной обкладки ДЭС происходит за счет электростатических сил и сил теплового движения, за счет последних сил ДЭС приобретает размытое диффузное строение. В создании ДЭС существенная роль принадлежит специфической абсорбции ионов.
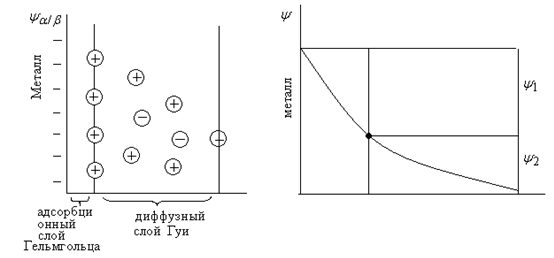
Под строением ДЭС понимают распределение зарядов в его ионной обкладке. (Гельмгольц, Штерн, Фрумкин). ДЭС состоит из двух частей:
1) Плотная или гельмгольцевская часть, образованная ионами, плотно подошедшими к поверхности металла (10-8см);
2) Диффузная часть, созданная ионами, находящимися от металла на расстоянии большем радиуса сольватированного иона (10-7-10-3см).
Рассмотрим пример: Проводник I рода (Cu) поместили в раствор CuSO4 (проводник II рода).
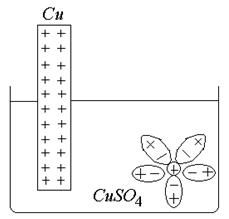 Металл: в узлах кристаллической решетки находятся ионы меди, расположенные упорядоченно. В растворе электролита и у поверхности ионы Cu2+ покрыты сольватной оболочкой из молекул воды.
Металл: в узлах кристаллической решетки находятся ионы меди, расположенные упорядоченно. В растворе электролита и у поверхности ионы Cu2+ покрыты сольватной оболочкой из молекул воды.
При равновесии 
Рассмотрим два случая:
1) 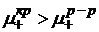 , т.е. химический потенциал катиона в кристаллической решетке больше химического потенциала катиона в растворе.
, т.е. химический потенциал катиона в кристаллической решетке больше химического потенциала катиона в растворе.
В этом случае ионы металла из твердого тела (проводника I р.) будут переходить в раствор до тех пор, пока: 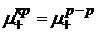 .
.
Поверхность металла заряжается отрицательно.
|
|
|
ψ – потенциал на границе металл - раствор
ψ1 – падение потенциала в плотном слое
ψ2 – падение потенциала в диффузной части.
ДЭС представляет собой как бы обкладку конденсатора.
2) 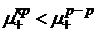 Ионы из раствора переходят на поверхность металла, заряжая ее положительно.
Ионы из раствора переходят на поверхность металла, заряжая ее положительно. 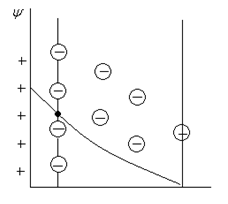
ДЭС возникает всегда на границе: проводник I рода – проводник II рода.
В целом ДЭС электронейтрален, его толщина зависит от концентрации раствора, заряда металла и температуры.
В концентрированных растворах диффузная часть практически отсутствует.
Устройство и изображение гальванического элемента
Гальваническим элементом называется любое устройство, дающее возможность получать электрический ток за счет проведения той или иной химической реакции.
Химические гальванические элементы состоят из неодинаковых электродов, на которых протекают различные по своей химической природе реакции.
Элементы, состоящие из двух одинаковых электродов, называются концентрационными. В этих элементах в электрическую энергию превращается работа выравнивания активностей окисленной и восстановленной форм реагирующего вещества в обоих электролитах.
Элементы, в которых общий раствор электролита, называются элементами без переноса. У них отсутствует диффузный скачек потенциала. В противном случае говорят об элементах с переносом, когда происходит перенос ионов на границе контакта двух различных растворов.
|
|
|
Рассмотрим устройство ГЭ на примере элемента Даниеля-Якоби.
Zn | Zn2+ ‖ Cu2+ | Cu
Обычно в ГЭ слева записывается полуэлемент, у которого более электроотрицательный электродный потенциал. ГЭ обычно состоит из двух проводников I рода (электродов), опущенных в растворы своих электролитов (Cu в СuSO4, Zn в ZnSO4). Между электролитами устанавливается полупроницаемая мембрана. К медному и цинковому электродам припаиваются медные провода.
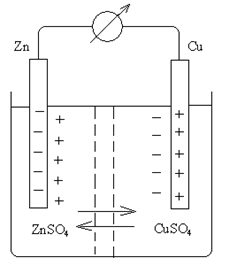
Через полупроницаемую перегородку проникают ионы SO42-
Замкнем цепь между двумя электродами гальванометром, происходит движение электронов, которые вызывают процесс окисления на цинковом электроде и восстановление на медном электроде. Причем два эти процесса пространственно разделены
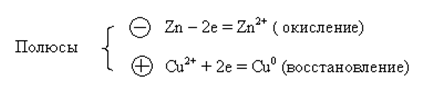
Zn + Cu2+ = Cu0 + Zn2+ − суммарная окислительно-восстановительная реакция.
При протекании окислительно-восстановительной реакции возникает ЭДС гальванического элемента, во внешней цепи появляется ток.
Схема разомкнутой цепи ГЭ:
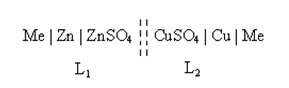
Величина ЭДС равна сумме скачков потенциалов на границах раздела фаз. Тогда
|
|
|
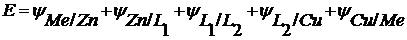
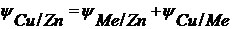 – контактный скачок потенциала.
– контактный скачок потенциала.
 – электродные скачки потенциала.
– электродные скачки потенциала.
 − жидкостный скачок потенциала. Если растворитель вода – диффузный скачок потенциала.
− жидкостный скачок потенциала. Если растворитель вода – диффузный скачок потенциала.
 может быть пренебрежительно снижен при использовании солевого моста. Этот процесс называется элиминирование.
может быть пренебрежительно снижен при использовании солевого моста. Этот процесс называется элиминирование.
Солевой мост представляет собой U- образную трубку, заполненную электролитом с одинаковой подвижностью катиона и аниона, и закрытую пробкой из проницаемого материала.
Дата добавления: 2018-04-05; просмотров: 677; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
