Удельная и эквивалентная электрические
Проводимости растворов электролитов
Мерой способности проводить электрический ток является электрическая проводимость L – величина, обратная электрическому сопротивлению
 (1.25)
(1.25)
R – сопротивление проводника, определяется природой Т и геометрией проводника.
Удельная электрическая проводимость раствора электролита – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2 и расположенными на расстоянии 1м друг от друга.
 , (1.26)
, (1.26)
где:
ρ – удельное сопротивление, Ом м
S – поперечное сечение, м2
l – длина проводника, м;
L – электрическая проводимость;
æ – удельная электрическая проводимость, Ом-1 м-1
Удельная электрическая проводимость определяется количеством ионов и скоростью миграции. За 1с ионы вида – i переносят 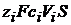 электричества, что соответствует силе тока:
электричества, что соответствует силе тока:
 – для всех видов ионов (1.27)
– для всех видов ионов (1.27)
Скорость движения иона
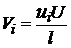 (1.28)
(1.28)
 (1.29)
(1.29)
U – приложенная разность потенциалов, В.
В соответствии с законом Ома
 (1.30)
(1.30)
Подставим значение J и получим
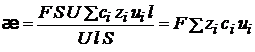 (1.31)
(1.31)
Для раствора бинарного электролита при концентрации С (моль/л),  и степени диссоциации α имеем
и степени диссоциации α имеем
|
|
|
 (1.32)
(1.32)
æ зависит от концентрации растворов, Р и Т.
 В области высоких концентраций снижается скорость движения ионов у сильных электролитов и степень диссоциации у слабых.
В области высоких концентраций снижается скорость движения ионов у сильных электролитов и степень диссоциации у слабых.
 При повышении температуры на 1° удельная электропроводимость электролитов возрастает на 2-2,5% вследствие уменьшения гидратации ионов и понижения вязкость растворов, а для слабых электролитов повышением степени диссоциации.
При повышении температуры на 1° удельная электропроводимость электролитов возрастает на 2-2,5% вследствие уменьшения гидратации ионов и понижения вязкость растворов, а для слабых электролитов повышением степени диссоциации.
При незначительном изменении давления электропроводимость электролитов почти не меняется. Заметное влияние на электропроводимость оказывает давление порядка сотен и тысяч атмосфер.
Эквивалентной электропроводимостью электролитов называют электропроводимость такого объема раствора V=1/c, в котором содержится 1 г-экв вещества и электроды располагаются на расстоянии 1 м друг от друга.
 , (1.33)
, (1.33)
где 
æ – удельная электропроводимость, Ом-1м-1,
С2* - концентрация растворенного вещества в г-экв/м3,
λэ – эквивалентная электропроводимость Ом-1м2/г-экв.
Молярная электрическая проводимость
|
|
|
Молярная электрическая проводимость − эта мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при расстоянии 1м между параллельными электродами.
Для одновалентных электролитов мольная электропроводимость (λ) равна эквивалентной электропроводимости (λэ). 
Для 1−2 валентных электролитов  , (CdCI2, H2SO4).
, (CdCI2, H2SO4).
Для 1−3 валентных электролитов  .
.
Между молярной и удельной электрической проводимостью имеется соотношение
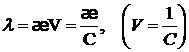 (1.34)
(1.34)
где:
λ – молярная электрическая проводимость  ,
,
V – разведение раствора, м3/моль
с – концентрация, моль/м3.
Если концентрация раствора выражена в моль/л, то
 (1.35)
(1.35)
С учетом, что  , следует
, следует

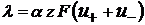 (1.36)
(1.36)
Значение молярной электропроводимости зависит от концентрации электролита.
На рисунке представлена зависимость молярной электрической проводимости от концентрации для сильных (1) и слабых (2) электролитов.
С увеличением разведения молярная электропроводимость возрастает и в области больших разведений стремится к предельному значению  , тогда
, тогда
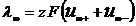 (1.37)
(1.37)
|
|
|
Произведение 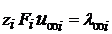 называется предельной электрической проводимостью ионов (
называется предельной электрической проводимостью ионов ( 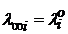 − иногда обозначают так).
− иногда обозначают так).
Тогда
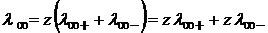 (1.38)
(1.38)
Гипотетический бесконечно разбавленный раствор характеризуется полной диссоциацией электролита и отсутствием электростатических сил.
λ ∞ − это сумма двух независимых слагаемых.
Закон независимого движения ионов Кольрауша:
 (1.39)
(1.39)
λ ∞ иона=f(Т, природа иона и растворителя)
Соотношение
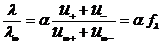 , (1.40)
, (1.40)
где  – коэффициент электрической проводимости.
– коэффициент электрической проводимости.
В разбавленных растворах  , отсюда
, отсюда
 (1.41)
(1.41)
Для сильных электролитов, когда α = 1
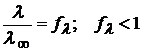 (1.42)
(1.42)
Теория электролитической проводимости растворов Дебая − Онзагера:
Снижение молярной электрической проводимости при переходе от разбавленных растворов к концентрированным растворам связано с уменьшением скорости движения ионов за счет:
1) эффекта электрофоретического торможения, обусловленного электростатическим взаимодействием между ионом и его ионной сферой;
2) эффектом релаксационного торможения (нарушение симметрии иона).
|
|
|
По теории Онзагера  ; для 1,1 – валентного электролита
; для 1,1 – валентного электролита
 (1.43)
(1.43)
где А и В – константы, полученные с учетом сил релаксационного и электрофоретического торможения.
Дата добавления: 2018-04-05; просмотров: 1360; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
