Ковалентная связь возникает при объединении электронов двух атомов неметаллов. Возникшая при этом структура называется молекулой
Полярная ковалентная связь
В большинстве случаев два ковалентно связанных атома имеют разную электроотрицательность и обобществленные электроны не принадлежат двум атомам в равной степени. Большую часть времени они находятся ближе к одному атому, чем к другому. В молекуле хлороводорода, например, электроны, образующие ковалентную связь, располагаются ближе к атому хлора, поскольку его электроотрицательность выше, чем у водорода. Однако разница в способности притягивать электроны не столь велика, чтобы произошел полный перенос электрона с атома водорода на атом хлора. Поэтому связь между атомами водорода и хлора можно рассматривать как нечто среднее между ионной связью (полный перенос электрона) и неполярной ковалентной связью (симметричное расположение пары электронов между двумя атомами). Частичный заряд на атомах обозначается греческой буквой δ. Такая связь называется полярной ковалентной связью, а о молекуле хлороводорода говорят, что она полярна, т. е. имеет положительно заряженный конец (атом водорода) и отрицательно заряженный конец (атом хлора).
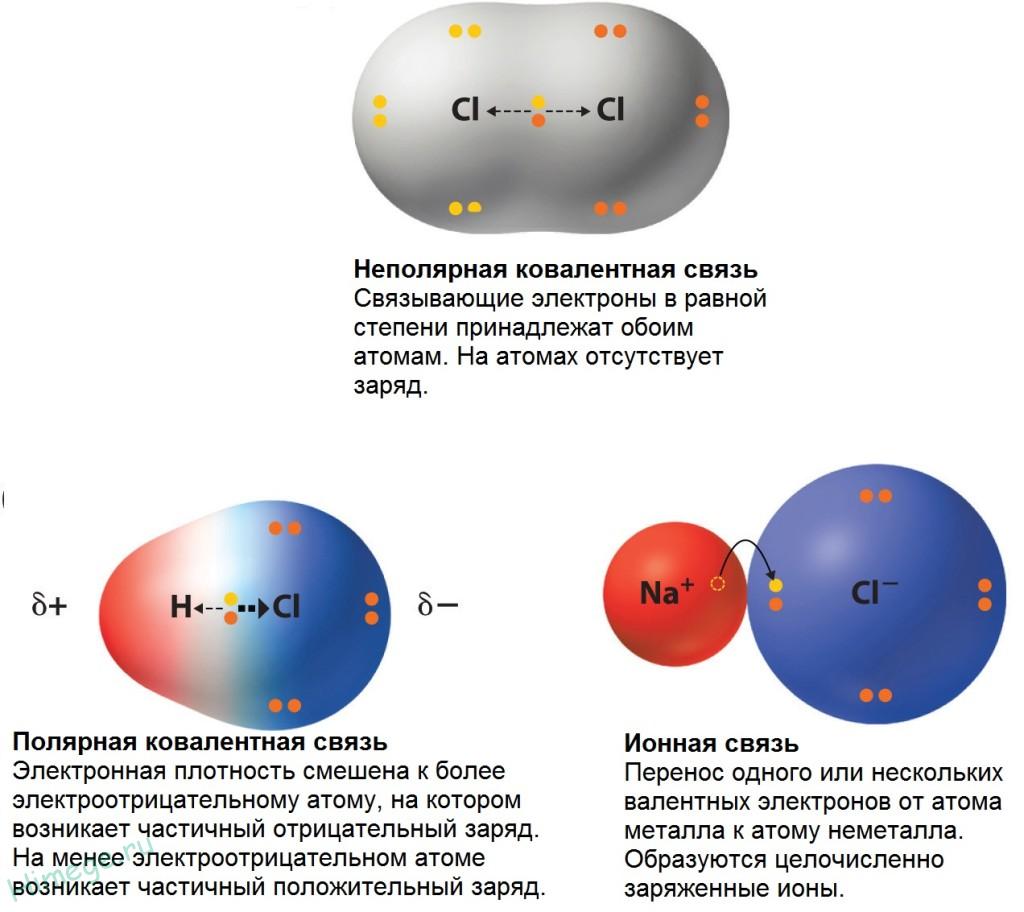
Типы химической связи
В таблице ниже перечислены основные типы связей и примеры веществ:

Типы химической связи
Обменный и донорно-акцепторный механизм образования ковалентной связи
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару.
|
|
|
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Представления гейтлера и лондона об образовании связи в молекуле водорода
Квантово-механическое описание строения молекул получают, как и в случае многоэлектронных атомов, лишь на основе приближенных решений уравнения Шредингера. Впервые подобный приближенный расчет был произведен в 1927 г. В. Гейтлером и Ф. Лондоном для молекулы водорода. Они сначала рассмотрели систему из двух атомов водорода, находящихся на большом расстоянии друг от друга. При этом условии можно учитывать только взаимодействие каждого электрона со «своим» ядром, а всеми остальными взаимодействиями (взаимным отталкиванием ядер, притяжением каждого электрона к «чужому» ядру, взаимодействием между электронами) можно пренебречь. Тогда оказывается возможным выразить зависимость волновой функции рассматриваемой системы от координат и тем самым определить плотность общего электронного облака в любой точке пространства. Далее Гейтлер и Лондон предположили, что найденная ими зависимость волновой функции от координат сохраняется и при сближении атомов водорода. При этом, однако, необходимо уже учитывать и те взаимодействия (между ядрами, между электронами и т. д.), которыми при значительном удалении атомов друг от друга можно было пренебрегать. Эти дополнительные взаимодействия рассматриваются как некоторые поправки («возмущения») к исходному состоянию электронов в свободных атомах водорода. В результате Гейтлер и Лондон получили уравнения, позволяющие найти зависимость потенциальной энергии Е системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов. При этом оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении спинов (рис. 3.1, кривая а) сближение атомов приводит к непрерывному возрастанию энергии системы. В этом случае для сближения атомов требуется затрата энергии, так что такой процесс оказывается энергетически невыгодным и химическая связь между атомами не возникает. При противоположно направленных спинах (рис. 3.1, кривая б) сближение атомов до некоторого расстояния r0 сопровождается уменьшением энергии системы. При r = r0 система обладает наименьшей потенциальной энергией, т. е. находится в наиболее устойчивом состоянии; дальнейшее сближение атомов вновь приводит к возрастанию энергии. Но это и означает, что в случае противоположно направленных спинов атомных электронов образуется молекула Н2 - устойчивая система из двух атомов водорода, находящихся на определенном расстоянии друг от друга.
|
|
|
|
|
|
Образование химической связи между атомами водорода является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих атомов (рис. 3.2). Вследствие такого взаимопроникновения плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра атомов притягиваются к области перекрывания электронных облаков. Это притяжение преобладает над взаимным отталкиванием одноименно заряженных электронов, так что в результате образуется устойчивая молекула.
Полученные Гейтлером и Лондоном расчетные значения межъядерного расстояния и энергии связи в молекуле водорода оказались близки к экспериментально найденным величинам. Это означало, что приближения, использованные Гейтлером и Лондоном при решении уравнения Шредингера, не вносят существенных ошибок и могут считаться оправданными. Таким образом, исследование Гейтлера и Лондона позволяло сделать вывод, что химическая связь в молекуле водорода осуществляется путем образования пары электронов с противоположно направленными спинами, принадлежащей обоим атомам
|
|
|
Представления о механизме образования химической связи, развитые Гейтлером и Лондоном на примере молекулы облаков в молекуле водорода, были распространены и на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). Метод ВС дал теоретическое объяснение важнейших свойств ковалентной связи, позволил понять строение большого числа молекул.
В основе метода ВС лежат следующие положения:
Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Билет 5(4)
Свойства ковалентной связи насыщаемость:
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства органических соединений.
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Билет 6(5)
Дата добавления: 2018-04-04; просмотров: 1041; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
