Скорость гетерогенных реакций
· Зависит от площади поверхности соприкосновения веществ, т.е. от степени измельчения веществ, полноты смешивания реагентов.
· Пример – горение древесины. Целое полено горит на воздухе сравнительно медленно. Если увеличить поверхность соприкосновения дерева с воздухом, расколов полено на щепки, скорость горения увеличится.
· Пирофорное железо высыпают на лист фильтровальной бумаги. За время падения частицы железа раскаляются и поджигают бумагу.
Билет 15(14)
Понятие о скорости химической реакции.
Влияние температуры на скорость реакции
В XIX веке голландский ученый Вант-Гофф опытным путем обнаружил, что при повышении температуры на 10 оС скорости многих реакций возрастают в 2-4 раза.
Правило Вант-Гоффа
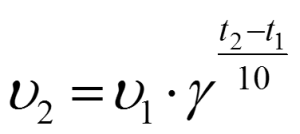
При повышении температуры на каждые 10◦С скорость реакции увеличивается в 2-4 раза.
Здесь γ (греческая буква «гамма») – так называемый температурный коэффициент или коэффициент Вант-Гоффа, принимает значения от 2 до 4.
Для каждой конкретной реакции температурный коэффициент определяется опытным путем. Он показывает, во сколько именно раз возрастает скорость данной химической реакции (и ее константа скорости) при повышении температуры на каждые 10 градусов.
Правило Вант-Гоффа используется для приближенной оценки изменения константы скорости реакции при повышении или понижении температуры. Более точное соотношение между константой скорости и температурой установил шведский химик Сванте Аррениус:
|
|
|

Чем больше Ea конкретной реакции, тем меньше (при данной температуре) будет константа скорости k (и скорость) этой реакции. Повышение Т приводит к увеличению константы скорости, это объясняется тем, что повышение температуры приводит к быстрому увеличению числа “энергичных” молекул, способных преодолевать активационный барьер Ea.
Влияние катализатора на скорость реакции
Можно изменить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией активации.
Катализаторы– это вещества, участвующие в химической реакции и увеличивающие ее скорость, но по окончании реакции остающиеся неизменными качественно и количественно.
Ингибиторы– вещества, замедляющие химические реакции.
Изменение скорости химической реакции или ее направления с помощью катализатора называюткатализом.

Билет 16(15)
Гомогенный и гетерогенный катализ.
Гомогенный и гетерогенный катализ во многом отличается друг от друга: в первом случае реакция происходит во всем объеме, вс втором - на поверхности. Однако йг преувеличение особой роли поверхности в гетерогенном катализе приводит к тому, что основные вопросы теории катализа пытаются связывать со структурой твердой поверхности. Считается, что основным, узловым вопросом теории катализа является решение вопроса о природе активных центров. Однако понятие активных центров не характерно для гомогенного катализа. Поэтому такой подход приводит к отказу от создания единой теории катализа. Преувеличение различий между гомогенным, гетерогенным и микрогетерогенным катализом приводит к разрыву между их теориями
|
|
|
При гомогенном катализе катализатор и реагирующие вещества образуют однородную систему, например газовые смеси или жидкие растворы. Возможны случаи, когда реагенты и катализатор - жидкости, но не смешивающиеся между собой
При гомогенном катализе катализатор и реагирующие вещества находятся в одном фазовом состоянии (газ, жидкость).
Пример, промышленное получение серной кислоты.
Реакция окисления: 2H2SO3 + O2 = 2H2SO4 – протекает медленно, она заменяется на быстрые каталитические реакции, где катализатором является NO:
O2 + 2NO = 2NO2, NO2 + H2SO3 = H2SO4 + NO.
Таким образом, гомогенные каталитические реакции протекают через образование промежуточных соединений, в которых участвует катализатор.
|
|
|
Многие природные и физиологические процессы, катализируемые ферментами, протекают по механизму гомогенного катализа: расщепление белков, дегидратация СО2 из крови и т. д.
При гетерогенном катализе катализатор и реагенты находятся в разных фазовых состояниях, чаще всего катализатор – твердое вещество, и реакция протекает на поверхности катализатора. Скорость такой реакции зависит от площади поверхности катализатора, поэтому последний часто наносят на вещества с развитой поверхностью – подложку (пористые угли, силикаты и пр.).
Как и в случае гомогенного катализа, при гетерогенном катализе реакция протекает через образование активных промежуточных соединений, которые представляют собой поверхностные соединения катализатора с реагирующими веществами. Проходя через ряд стадий (подвод реагентов в зону реакции, адсорбция на поверхности катализатора, собственно химическая реакция, десорбция), в которых участвуют и промежуточные соединения, реакция заканчивается образованием конечных продуктов, а катализатор – не расходуется.
Гетерогенный катализ в промышленности применяется при получении аммиака, азотной и серной кислот, водорода и пр. К наиболее распространенным катализаторам относятся: Pt, Ni, Pd, CuO, V2O5, Al2O3, SiO2 и др. Применение каталитических процессов обеспечивает экономию сырья и энергии, а также решает экологические задачи.
|
|
|
Билет 17(16)
Дата добавления: 2018-04-04; просмотров: 783; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
