ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
Билет 1.
Основные положения квантово-волновой механики:
2.1 Волны де-Бройля. Соотношение неопределенностей Гейзенберга
Луи де Бройль опубликовал выведенное им соотношение в качестве составной части своей докторской диссертации в 1924 году. Казавшееся сначала сумасшедшей идей, соотношение де Бройля в корне перевернуло представления физиков-теоретиков о микромире и сыграло важнейшую роль в становлении квантовой механики. В дальнейшем карьера де Бройля сложилась весьма прозаично: до выхода на пенсию он работал профессором физики в Париже и никогда более не поднимался до головокружительных высот революционных прозрений.
Теперь кратко опишем физический смысл соотношения де Бройля: одна из физических характеристик любой частицы — ее скорость. При этом физики по ряду теоретических и практических соображений предпочитают говорить не о скорости частицы как таковой, а о ее импульсе (или количестве движения), который равен произведению скорости частицы на ее массу. Волна описывается совсем другими фундаментальными характеристиками — длиной (расстоянием между двумя соседними пиками амплитуды одного знака) или частотой (величина, обратно пропорциональная длине волны, то есть число пиков, проходящих через фиксированную точку за единицу времени). Де Бройлю же удалось сформулировать соотношение, связывающее импульс квантовой частицы р с длиной волны λ, которая ее описывает:
|
|
|
p = h/λ или λ = h/p
где h — постоянная Планка.
Это соотношение гласит буквально следующее: при желании можно рассматривать квантовый объект как частицу, обладающую количеством движения р; с другой стороны, ее можно рассматривать и как волну, длина которой равна λ и определяется предложенным уравнением. Иными словами, волновые и корпускулярные свойства квантовой частицы фундаментальным образом взаимосвязаны.
Соотношение де Бройля позволило объяснить одну из величайших загадок зарождающейся квантовой механики.
Следует отметить, что соотношения неопределенностей Гейзенберга не связаны с несовершенством измерительных приборов, а являются следствием корпускулярно-волнового дуализма микрочастиц. 2.2 Статистическое толкование волн де-Бройля. По своей природе волны де-Бройля отличаются от известных волн. Они имеют особый физический смысл. Первоначально волна де-Бройля интерпретировалась как распределение материи электрона в пространстве. Однако такое истолкование наталкивается на принципиальные трудности. Например, при дифракции волна делится на части, а на опыте всегда имеем дело с целым электроном, который вследствие волновых свойств может попасть или в одну точку пространства, или в другую. Наиболее правильным толкованием волн де-Бройля, позволяющим связать корпускулярные и волновые свойства микрочастиц является статистическое толкование: интенсивность волны де-Бройля пропорциональна вероятности обнаружить частицу в данной точке пространства. Таким образом, со статистической точки зрения волны де-Бройля можно рассматривать как волны вероятности. Начав со сложных математических формул, описывающих мир на субатомном уровне, он постепенно пришел к удивительной по простоте формуле, дающий общее описание эффекта воздействия инструментов измерения на измеряемые объекты микромира, о котором мы только что говорили. В результате им был сформулирован принцип неопределенности, названный теперь его именем:
|
|
|
неопределенность значения координаты x неопределенность скорости > h/m,
математическое выражение которого называется соотношением неопределенностей Гейзенберга:
Δx х Δv > h/m
где Δx — неопределенность (погрешность измерения) пространственной координаты микрочастицы, Δv — неопределенность скорости частицы, m — масса частицы, а h —постоянная Планка, названная так в честь немецкого физика Макса Планка, еще одного из основоположников квантовой механики. Постоянная Планка равняется примерно 6,626 x 10–34 Дж·с, то есть содержит 33 нуля до первой значимой цифры после запятой.
|
|
|
Термин «неопределенность пространственной координаты» как раз и означает, что мы не знаем точного местоположения частицы. Относительно принципа неопределенности нужно сделать еще два важных замечания:
он не подразумевает, что какую-либо одну из двух характеристик частицы — пространственное местоположение или скорость — нельзя измерить сколь угодно точно;
принцип неопределенности действует объективно и не зависит от присутствия разумного субъекта, проводящего измерения.
Луи де Бройль (1924 г.) показал, что все микрочастицы (в том числе и электрон) обладают двойственной корпускулярно-волновой природой. Движение любой микрочастицы представляет собой волновой процесс, описываемый следующим соотношением (уравнением де Бройля):
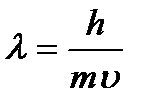 ,
,
где m – масса частицы, г;
u - скорость частицы, м/с.
Волны, соответствующие движущимся частицам, получили название волн де Бройля.
В 1927 г. гипотеза Луи де Бройля, приписывающая электрону волновые свойства, была подтверждена экспериментами американских физиков Девиссона и Джермера. Они обнаружили, что при столкновении пучка медленных электронов с кристаллическим телом (кристаллической решёткой) наблюдается явление дифракции, аналогичное явлению дифракции рентгеновских лучей.
|
|
|
Уравнение Шредингера
В квантовой механике состояние системы полностью описывается волновой функцией. Это значит, что если задана волновая функция, в какой то момент времени t, то она будет определять волновую функцию и во все последующие моменты времени, т.е. изменение волновой функции с течением времени (еѐ первая производная) должна выражаться через неѐ.
Шрёдингер применил к понятию волн вероятности классическое дифференциальное уравнение волновой функции и получил знаменитое уравнение, носящее его имя. Подобно тому как обычное уравнение волновой функции описывает распространение, например, ряби по поверхности воды, уравнение Шрёдингера описывает распространение волны вероятности нахождения частицы в заданной точке пространства. Пики этой волны (точки максимальной вероятности) показывают, в каком месте пространства скорее всего окажется частица. Хотя уравнение Шрёдингера относится к области высшей математики, оно настолько важно для понимания современной физики, что я его все-таки здесь приведу — в самой простой форме (так называемое «одномерное стационарное уравнение Шрёдингера»). Вышеупомянутая волновая функция распределения вероятности, обозначаемая греческой буквой ψ («пси»), является решением следующего дифференциального уравнения (ничего страшного, если оно вам не понятно; главное — примите на веру, что это уравнение свидетельствует о том, что вероятность ведёт себя как волна):
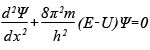
где x — расстояние, h — постоянная Планка, а m, E и U — соответственно масса, полная энергия и потенциальная энергия частицы.
Картина квантовых событий, которую дает нам уравнение Шрёдингера, заключается в том, что электроны и другие элементарные частицы ведут себя подобно волнам на поверхности океана. С течением времени пик волны (соответствующий месту, в котором скорее всего будет находиться электрон) смещается в пространстве в соответствии с описывающим эту волну уравнением. То есть то, что мы традиционно считали частицей, в квантовом мире ведёт себя во многом подобно волне.
При́нцип Па́ули (принцип запрета) — один из фундаментальныхпринципов квантовой механики, согласно которому два и более тождественных фермиона (частицы с полуцелым спином) не могут одновременно находиться в одном и том же квантовом состоянии.
В1925 г. швейцарский физик В.Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, обладающих одинаковыми свойствами.
Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так:
В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Хотя бы одно из квантовых чисел n, l, ml и ms, должно обязательно различаться проекцией спина. Поэтому в атоме могут быть лишь два электрона с одинаковыми n, l и ml: один с ms = +1/2 другой c ms = -1/2 . Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел n, l или ml.
Зная принцип Паули, посмотрим, сколько же электронов в атоме может находиться на определенной «орбите» с главным квантовым числом n. Первой «орбите» соответствует n = 1. Тогда l = 0, ml=0 и ms может иметь произвольные значения: +1/2 или -1/2 . Мы видим, что если n = 1, таких электронов может быть только два.
В общем случае, при любом заданном значении n электроны прежде всего отличаются побочным квантовым числом l, принимающим значения от 0 до n 1. При заданных n и l может быть (2l + 1) электронов с разными значениями магнитного квантового числа ml. Это число должно быть удвоено, так как заданным значениям n, l и ml соответствуют два разных значения проекции спина ms.
Следовательно, максимальное число электронов с одинаковым квантовым числом n выражается суммой
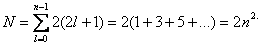
Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором — 8, на третьем — 18 и т.д.
Рассмотрим, например, атом гелия. В атоме гелия 2He квантовые числа n = 1, l = 0 и ml = 0 одинаковы для обоих его электронов, а квантовое число ms отличается. Проекции спина электронов гелия могут быть ms = +1/2 или ms = -1/2 . Строение электронной оболочки атома гелия 2Не можно представить как 1s2 или, что то же самое
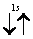
Заметим, что в одной квантовой ячейке согласно принципу Паули никогда не может быть двух электронов с параллельными спинами.
Третий электрон лития согласно принципу Паули уже не может находиться в состоянии 1s, а только в состоянии 2s:
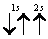
Билет 2
ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
Располагая элементы в порядке возрастания их атомных весов, Д. И. Менделеев обнаружил фундаментальный закон природы, который теперь известен как Периодический закон:
Дата добавления: 2018-04-04; просмотров: 469; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
