Тема 9. Электропроводность растворов электролитов
Изучение этого раздела начните с разбора понятий удельная и эквивалентная электропроводность λv. Рассмотрите факторы, влияющие на эти величины, разберитесь в их зависимости от концентрации в растворах сильных и слабых электролитов.
В конспекте по этой теме графически представьте зависимость λv от концентрации, дайте объяснение этой зависимости. Практическое применение методов электропроводности связано с законом Кольрауша, уясните его физический смысл.
Вопросы для самопроверки:
1. Что такое удельная электропроводность? Эквивалентная электропроводность?
2. Что такое подвижность ионов?
3. Какие различия наблюдаются в изменении эквивалентной электропроводности с разбавлением в растворах слабых и сильных электролитов?
4.Какое практическое значение имеет определение электропроводности?
5. Что такое кондуктометрическое титрование?
Решение типовой задачи
Вычислить степень и константу электролитической диссоциации 0,01 н раствора уксусной кислоты, эквивалентная электропроводность которого при 18°С равна 1,47 см-м2 кмоль–1
Решение. Эквивалентная электропроводность при данном разбавлении λv =1,47. Эквивалентная электропроводность при бесконечном разбавлении:
λ∞ = λ+ + λ–, где λ+ и λ– - электролитические подвижности аниона и катиона диссоциируемой кислоты.
СН3СООН = СН3СОО– + Н+


λ∞ = 31,5 + 3,5 = 35,0

Согласно закону разбавления, константа электролитической диссоциации слабого бинарного электролита  ., где
., где
|
|
|
α – степень электролитической диссоциации;
С – концентрация в молях на литр раствора.
 .
.
Тема 10. Электрохимия
Одним из основных разделов электрохимии является учение об электродвижущих силах гальванических элементов. Гальванический элемент представляет собой систему из проводников I и II рода, в которой за счет химической реакции образуется электрический ток. В каждом работающем гальваническом элементе происходит окислительно-восстановительный процесс, причем окисление идет на одном электроде (отрицательном), а реакция восстановления на другом электроде (положительном).
Изучение этого раздела следует начать срассмотрения механизма возникновения потенциала на границе раздела двух фаз, разобраться в понятиях электрод, гальванический элемент, электродвижущая сила гальванического элемента и вывести уравнение электродного потенциала:
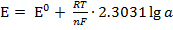 , или, подставив числовые значения R= 8,313 Дж/моль и F = 96500 кулонов, получим:
, или, подставив числовые значения R= 8,313 Дж/моль и F = 96500 кулонов, получим:

Необходимо усвоить понятие стандартный (нормальный) электродный потенциал и уравнение электродвижущей силы гальванических элементов (Е= Е1 – Е2), затем рассмотретьвозникновение диффузионного потенциала, концентрационные элементы, электроды сравнения и перейти к потенциометрическому методу определения рН, изучить устройство индикаторных электродов и электродов сравнения. Обратите внимание на методы определения окислительно-восстановительных потенциалов почв.
|
|
|
Вопросы для самопроверки:
1. Что представляют собой гальванические элементы?
2. Какова роль молекул растворителя в возникновении двойного электрического слоя награнице металл-раствор?
3. Какой потенциал называется электродным?
4. Какие скачки потенциалов выделяют в гальваническом элементе?
5.Почему принятые величины стандартных электродных потенциалов являются относительными, а не абсолютными?
6. Что такое диффузный потенциал? Как и почему его устраняют?
7. В чем заключается принцип потенциометрического метода определения рН? Как устроен рН-метр?
8. Какие потенциалы называются окислительно-восстановительными?
9. Что такое потенциометрическое титрование?
10.Перечислите мембранные электроды. Сравните возникновение скачка потенциала на мембранном электроде с возникновением скачка потенциала на окислительно-восстановительном электроде.
|
|
|
11. Что такое окислительно-восстановительные (редокс-) потенциалы? Как и для чего определяют редокс-потенциалы почв?
Решение типовой задачи
Электродвижущая сила хингидронно-каломельной цепи при температуре 18° С равна 0,310 В. Вычислить рН раствора.
Решение. Pt / хингидрон, Н+/ KCl, насыщенный Hg2Cl2 / Hg

Тогда Е = (Еxr – Eкал) +  –
–  =
=  .
.
Так как –  = рН, то рН =
= рН, то рН = 
При 18оС Еxr = 0,7044 В
Екал = 0,203 В
 = 0,058
= 0,058
рН = 
Дата добавления: 2018-02-28; просмотров: 829; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
