Тема 5. Фотохимические реакции
Химические реакции, протекающие под действием света, называются фотохимическими. Наибольшее значение из них имеет фотосинтез. В этом разделе надо обратить внимание на сущность процесса фотосинтеза и роль хлорофилла в нем.
Вопросы для самопроверки:
1. Какие реакции называются фотохимическими?
2. Напишите суммарное уравнение фотосинтеза.
3. Что такое квантовый выход?
4. Какова роль хлорофилла в процессе фотосинтеза?
Тема 6. Химическое равновесие
В учении о химическом равновесии рассматриваются обратимые химические процессы. С точки зрения химического равновесия, обратимые процессы - это процессы, протекающие одновременно в двух противоположных направлениях. С точки зрения термодинамики, обратимые процессы протекают бесконечно медленно. При этом никаких изменений во внешней среде не наблюдается. В конспекте необходимо представить выражения для констант равновесия обратимых гомогенных и гетерогенных реакций, в том числе и с использованием парциальных давлений. Рассмотрите таблицы констант равновесия процессов растворения малорастворимых веществ (ПР), диссоциации, гидролиза. Что можно рассчитать с помощью этих таблиц? Особое значение в этой теме имеет установление связи между константой равновесия и изменением изобарного потенциала. Решите типовые задачи по этой теме. Потренируйтесь в определении смещения равновесия на основе принципа Ле-Шателье.
|
|
|
Вопросы для самопроверки:
1. Какое состояние системы называется химическим равновесием? Чем характеризуется химическое равновесие?
2. Что такое смещение равновесия? Какие факторы влияют на химическое равновесие?
3. Сформулируйте принцип Ле-Шателье. Укажите направления смещения равновесия С+О2=СО2+q при понижении температуры, давления, при увеличении концентрации О2.
4. Какова связь между константой равновесия и изобарным потенциалом реакции?
5. Влияет ли катализатор на положение равновесия? на величину константы равновесия?
6. Какие факторы влияют на Кравн? на равновесные концентрации?
7. Какие таблицы констант равновесия Вам известны?
8. Какой порядок имеют величины констант равновесия для химически обратимых и практически необратимых реакций? Приведите примеры таких реакций.
Решение типовых задач
1. Найти константу равновесия реакции при температуре 298°К:
С2Н2 (газ) +2Н2 (газ) =С2Н6 (газ), если ∆Gреакц.=–281,2 кДж/моль.
Решение. Связь между константой равновесия в стандартных условиях и стандартным изобарным потенциалом реакции выражается уравнением:
 или, при переходе к десятичным логарифмам,
или, при переходе к десятичным логарифмам,
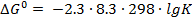 , отсюда:
, отсюда:
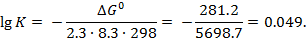
Используя таблицу логарифмов. Находим значение К:
|
|
|
lg K = –0,049 или lg K = 1.950,

2. Найти константу равновесия при температуре 298оК реакции:
С2Н2 (г) + 2Н2(г) = С2Н2 (г),
если ∆Нореакц. = –324,2 кДж/моль,
∆Sореакц. = 10,22 Дж/Кмоль.
Решение. Связь между константой равновесия в стандартных условиях и стандартным изобарным потенциалом реакции выражается уравнением:
 , или, при переходе к десятичным логарифмам:
, или, при переходе к десятичным логарифмам:
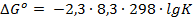 (1)
(1)
Стандартный изобарный потенциал связан со стандартными значениями энтальпии и энтропии химической реакции соотношением:
∆Go = ∆Ho – T∆So(2)
Найдем величину изобарно-изотермического потенциала по уравнению (2) из данных задачи, переведя ∆Ho в джоули.
∆Go = –324230 – 298(–10,22) = –321,2 кДЖ/моль.
Теперь, пользуясь найденным значением, рассчитываем lgK:

Используя таблицу логарифмов, находим значение К:
lg K = –0.39

Дата добавления: 2018-02-28; просмотров: 940; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
