Тема3.Основы химической термодинамики
Термодинамический метод полезен для прикладной химии тем, что позволяет рассчитать для химических реакций и других физико-химических процессов (фазовые переходы, растворение, адсорбция, электродные процессы и т. д.): а) тепловой эффект (расчет ∆Н), б) принципиальную возможность протекания процесса в нужном направлении (расчет ∆G), в) глубину протекания процесса - выход продуктов - и ее изменение в зависимости от условий (расчет Кравн.).
Для этого в термодинамику вводятся, так называемые, термодинамические функции состояния - величины часто абстрактные, связанные между собой и с измеряемыми свойствами системы (параметрами состояния) математическими зависимостями на основе законов термодинамики.
Советуем начать с ознакомления с содержанием программы и с указанных параграфов учебника, типовыми задачами и, что очень важно, с таблицами стандартных термодинамических функций. К этим таблицам следует возвращаться и в дальнейшем при более углубленном изучении материала с тем, чтобы проанализировать порядок величии термодинамических функций, характер их изменения в зависимости от различных факторов.
В конспекте должны быть определения, принятые обозначения и размерности параметров и функций состояния и математические выражения их связывающие.
Вас не должно пугать обилие новых терминов и формул. Нужно понять их смысл и уметь использовать при решении задач.
|
|
|
Вопросы для самопроверки:
1. Что такое параметр состояния?Какие параметры состояния термодинамической системы являются интенсивными?экстенсивными? Перечислите термодинамические параметры, применяющиеся для описания систем (в том числе и биологических), в которых протекает химическая реакция.
2.Какформулируетсяпервоеначалотермодинамики? Приведите его математическое выражение.
3.Что такое энергия?Перечислите известные вамвиды энергии.
4.Что понимается под внутренней энергиейтермодинамической системы? Что такое энтальпия? Какова связь между внутренней энергией и энтальпией?
5.КакформулируетсязаконГесса?Какрассчитывают тепловые эффекты реакций, которые не могут быть найдены экспериментально? Какие для этого необходимы данные?
6.Что такое теплотасгорания, как ее определяют экспериментально?
7.Как формулируется второе начало термодинамики?
8.Какие процессы в термодинамике называются обратимыми и необратимыми? Приведите примеры.
9.Что такое энтропия?Какой физический смыслимеет различие величин ∆S и ∆Qв случае необратимых процессов? Как может изменяться энтропия изолированной, закрытой и открытой систем?
10.Каково статистическое толкование понятия энтропия?
|
|
|
11.Сформулируйте третий закон термодинамики. Как на его основе производят вычисление абсолютных энтропии? Длячего нужны эти величины?
12.Как связаноизменение изобарного потенциаласнаправлением химических процессов?
13.Каким уравнением связаны величины ∆G, ∆H и ∆S?
14.Как связана величина свободной энергии химического процесса с константой его равновесия? Каково значение этого выражения?
Решениетиповыхзадач
1. Определить тепловой эффект реакции образования сульфата алюминия из оксида алюминия и оксида серы при стандартных условиях. Тепловой эффект реакции (q) по принятой в термохимии системе знаков равен изменению энтальпии (∆Нреакц) в ходе реакции, взятому с обратным знаком.
Решение. Для стандартной температуры и стандартных условий *q = –∆Нореакц. По закону Гесса:
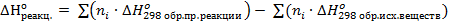 ,
,
где ∑ - знак суммирования;
ni – стехиометрические коэффициенты;
∆Но298 – стандартные энтальпии образования (или теплоты образования) химических веществ;
∆Но298 – табличные значения. Приведены в таблице 2 приложения.
Решение задачи рекомендуется проводить по следующей схеме:
1) Составляем уравнение реакции (в скобках указываем агрегатное состояние вещества).
|
|
|
2) Находим по таблице 2 приложения значения ∆Но298образования Al2O3, Al2(SO4)3 и под каждым химическим символом уравнения реакции подписываем значение ∆Но298, взятое из таблицы, с множителем, равным стехиометрическому коэффициенту:
| ∆Но298: | Al2O3 | + | 3SO3 | = | Al2(SO4)3 |
| кДж/моль | –1670 | 3(–395) | –3444,9 |
3) Суммируем все значения энтальпий продуктов реакции и вычитаем из них сумму энтальпий исходных веществ:
∆Но298 = –3444,9 –(–1670) – 3(–395) = –589,9 кДж
Итак, q = –∆Нореакц = 589,9 кДж/моль. Реакция экзотермическая. термохимическое уравнение образования сульфата алюминия из оксидов:
Al2O3 + 3SO3 = Al2(SO4)3 + 589,9 кДж.
2. Определить тепловой эффект реакции образования бензола из углерода и водорода по теплотам сгорания С6Н6 (ж), Н2 (г), С(тв).
Решение. Решение проводим по схеме, предложенной в предыдущем примере:
1) Составляем уравнение реакции.
2) Находим в таблице 2 приложения значения ∆Но сгорания; записываем из под соответствующимихимическими символами в уравнение реакции:
| ∆Носгорания: | 6С (тв) | + | 3Н2 (г) | = | С6Н2 (ж) |
| кДж/моль | 6(–393,8) | 3(–286,0) | –3269,9 |
3) По закону Гесса:
 ,
,
тогда ∆Нореакц. = 6(–393,8) + 3(–286,0) – (–3269,9) = 49,2 кДж
|
|
|
Тепловой эффект реакции образования бензола С6Н2 (ж):
q = –∆Нореакц = –49,2 кДж/моль
Рекомендуемым способом * можно решать задачи на определение изменений стандартных энтропий (∆S) и изобарного потенциала (∆G) в ходе химических реакций по данным Sо298Gо298 образования участвующих в реакции веществ, пользуясь уравнениями:
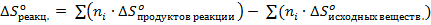 ,
,
 ,
,
Дата добавления: 2018-02-28; просмотров: 775; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
