Биологически активные производные пиррола
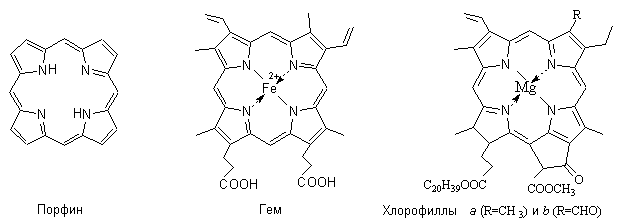
Тетрапиррольные соединения содержат ароматический макроцикл порфин, включающий четыре пиррольных кольца.
Замещенные порфины называют порфиринами. В виде комплексов с металлами порфирины и частично гидрированные порфирины входят в состав важных природных соединений – гема (простетической группы гемоглобина – содержащегося в эритроцитах основного белка дыхательного цикла, переносчика кислорода от органов дыхания к тканям), зеленого пигмента растений хлорофилла, витамина В12.
Биаог
2.Буферными системами(БР) (растворами) называются растворы, обладающие свойствами достаточно стойко сохранять постоянство концентрации водородных ионов как при добавлении кислот или щелочей, так и при разведении.
Компоненты Буферного раствора противодействующие изменению pH называются буферными системами( БС).
Классификация Б.С.
По составу:
-Кислотные – состоят из слабой кислоты и её соли, образованной сильным основанием.
-Ацетатная БС (CH3COOH/CH3COONa)
-Гидрокарбонатная (H2CO3/NaHCO3)
-Фосфатная (NaH2PO4/Na2HPO4)
-Белковая (Pt-COOH/Pt-COONa)
-Гемоглобиновая
-Оксигемоглобиновая
Последние 2 БС часто объединяют под названием система гемоглобин-оксигемоглобин
Все КБС кроме ацетатной имеются в организме человека
Фосфатная БС иногда выделяется в состав солевых БС.
Основные БС – состоит из слабого основания и его соле-оксидной кислоты
Пример – аммиачная БС (NH4OH/NH4Cl)
|
|
|
Солевые. Состоят из кислой и средней соли или двух кислых солей. Например, карбонатная буферная система (NaHCO3 + Na2CO3), фосфатная буферная система (КН2PO4 + К2НPO4).
Амфотерная БС – БС содержащая функциональную группу основного и кислотного характера.
Пример – Аминокислотная БС
Белковая БС
2. по природным компонентам : неорганические и органические.
Уравнение Гендельсона-Гассельбаха
КБС на примере ацетатной
Состав – уксусная кислота и ацетат натрия.
Уксусная кислота – слабый электролит, поэтому частично и обратимо диссоциирует.
CH3COOH = CH3COO- + H+(1)
На основании ЗДМ можно записат
КК= 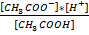 (2)
(2)
KK – константа кислотности CH3COOh
[H+] =KK 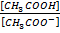
Это уравнении только для раствора уксусной кислоты, если к раствору уксусной кислоты добавить ацетат натрия, то образуется ацетатная БС.
С учётом необратимости процесса
CH3COONa = CH3COO- +Na+
Получим:
[H+] =KK 
Это уравнение можно применить к любой КБС.
Прологарифмировав это уравнение и умножив на -1
-lg[H+] = -lg Kk - lg 
т.к. -lg[H+] = pH и принимая, что -lgKk= рКК(показатель константы кислотности).
Получим итоговое уравнение:
pH = рКК- lg  = рКК+ lg
= рКК+ lg 
ОБС на примере аммиачной БС.
Состав - NH4OH/NH4Cl
NH4OH = NH4+ + OH-
NH4Cl = NH4++ Cl-
Образующиеся ионы NH4+ подавляют диссоциацию NH4OH в соответствии с принципом Ле-Шателье
|
|
|
После преобразования аналогичных для ацетатной БС получим.
pОH = рКО- lg  = рКО+ lg
= рКО+ lg 
рКО – показатель константы основности
рКО= Ки(ионизации)+КД(диссоциации)=Кравновесия
pH+ pОH =14
pH= 14-pОH
pH= 14 – (рКО- lg 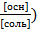
pH= 14 – рКО+ lg 
Вывод:pH БС зависит от: природы слабого электролита (КО, КК), являющегося компонентом БР; отношения концентрации компонентов БС.
1. Напишите строение антикодона в т-РНК, соответствующего кодону УГУ в и-РНК.
Антикодоны тРНК комплементарны кодонам иРНК. Т.о. антикодон будет представлен последовательностью нуклеотидов, комплементарных урацилу, гуанину, урацилу. Таковыми нуклеотидами, соотвественно, являются: аденин (А), цитозин(Ц) и аденин (А). т.о., строение антикодона –АЦА
Дата добавления: 2018-02-28; просмотров: 600; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
