Внутренняя энергия. Энтальпия. Теплота и работа – две формы передачи энергии
Билет №2
Первое начало термодинамики: формулировки, применение к биосистемам.
Первое начало термодинамики- это частный случай закона сохранения вещества.
Вечный двигатель 1го рода невозможен, т.е. невозможно создать машину, которая производила бы без подведении энергии из вне,иначе говоря «создавать энергию»
Кол-во теплоты, полученное термодинамической системой расходуется на увеличение внутренней и внешней энергии работы, совершаемую против действия внешних сил.
Q=∆U+A, преобразовав получим ∆U= Q-А
U-внутренняя энергия
Q-кол-во теплоты
А- работа,совершаемая против действия внешних сил.
Применение к биосистема.Живой организм не является источником новой энергии, поэтому полностью подчиняется требованиям 1го закона ТД, со следующей формулировкой: Все виды работ в организме совершаются за счет эквивалентного кол-ва энергии, выделяющийся при окислении химических веществ(3я формулировка).
2. В 200 мл фосфатного буферного раствора содержится 0,8 моль кислотного компонента (Н2РО4- ) и 1,6 моль солевого компонента (НРО42–).
Установите рН буферного раствора.
Объясните, входит ли рассчитанное значение рН в ЗБД (рН: 6,2 – 8,2).
Ки (Н2РО4-) = 6,2×10-8 моль/л; lg 2 = 0,3; lg 6,2 = 0,79.
Классифицируйте буферную систему по составу и природе компонентов.
Решение.
1.Подставим данные задачи в формулу для расчета рН фосфатного буфера:
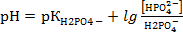 =-lg(6,2×10-8) +lg(1,6/0,8)=7,51
=-lg(6,2×10-8) +lg(1,6/0,8)=7,51
2.Рассчитанное значение рН входит в зону буферного действия( ЗБД) рН: 6,2 – 8,2
3.Фосфатная буферная система является кислотно-основной буферной системой, образованной анионами двух кислых солей
3.Напишите схему получения пропилбензоата из кислоты и спирта.
Опишите механизм этой реакции.
Сравнитеацилирующую способность бензойной и уксусной кислот.
Укажите роль кислотного катализатора.
Объясните возможность гидролиза пропилбензоата в кислой и щелочной среде.
Подтвердите Ваше предположение соответствующими уравнениями. .
Ответ:
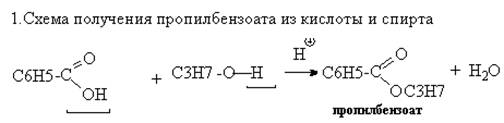
2.Механизм реакции этерификации – нуклеофильное замещение SN : замещение ОН-группы на алкоксигруппу (ОС3Н7).
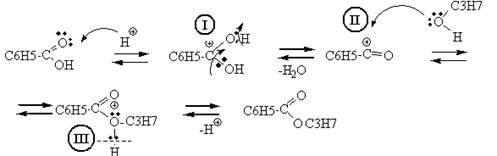
Роль катализаторов в реакции этерификации играют ионы водорода. Кислород карбоксильной группы, захватывая протон, образует карбониевый ион I. Соединение I присоединяет молекулу спирта за счет неподеленных электронов кислородного атома с образованием промежуточного комплекса II, Этот комплекс способен обратимо распадаться с отщеплением воды и образованием нового карбониевого катиона сложного эфира III, который при диссоциации образует сложный эфир, причем освобождается катализатор – протон.
3. Электронодонорныезаместителиуменьшаютэлектрофильность карбонильного атома углерода и, следовательно, понижают реакционную способность оксосоединения. Фенильный радикал С6Н5 в бензойной кислоте обладает более выраженными донорными свойствами, чем метильный радикал в уксусной кислоте. Как следствие, реакция этерификации с участием бензойной кислоты протекает медленнее, чем в случае алифатических. Таким образом, ацилирующая способность бензойной кислоты ниже, чем уксусной.
4. Роль кислотного катализатора – участие в образовании промежуточного карбониевого иона I .
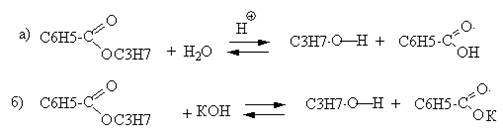
5. Гидролиз пропилбензоата в кислой среде протекает с образованием пропилового спирта и бензойной кислоты (реакция а), в щелочной среде – пропилового спирта и бензоата (реакция б):
БИЛЕТ 3
1)Основные понятия термодинамики: система, параметры, состояние, процесс (определение, классификация, примеры).
Термодинамическая система- это любой реальный объект, выделяемый из окружающей среды с целью изучения процессов обмена в-вом и энергией между составляющими его частями, а так же между ним и окружающей средой с помощью термодинамических методов
Классификация ТС
1.
1. Открытые обмениваются с ОС как в-вом, так и энергией(организм, открытый сосуд с кипящей водой)
2. Закрытый –обменивается с ОС только энергией в форме теплоты или работы (газ в закрытом балоне)
3. Изолированные- не обмениваются ни в-вом, ни энергии. В природа абсолютно изолир-х нет
4. По наличию пов-ти раздела внутри ТС
1. Гомогенные – пов-ть раздела отсутствует, все компоненты находятся в одой фазе, все физ и химсв-ва в любой части объема одинаковы (смесь газов)
2. Гетерогенные-содержится пов-ть раздела, отделяющие части системы(фазы) различны по св-вам (кровь)
Параметры –величины, определяющие состояния ТС
По возможности непосредственного измерения
1. Основные параметры-параметры, которые можно измерить с помощью соотв-х приборов (m, V, C,плотность, объем)
2. Функции состояния - внутренняя энергия E(U);энтальпия (H); энтропия (S); энергия Гиббса (G); свободная энергия или энергия Гельмгольца
Можно определить изменение значений функции состояния
∆X(X2-X1), ГДЕ Х-U,H,S,G,H
Термодинамическое состояние-совокупность значений некоторого числа физ. величин, характеризующих все физ и хм св-ва системы
Виды состояний:
Неравновесное- параметры меняются самопроизвольно(стакан с горячей водой)
Равновесное-параметры не меняются без внешних воздействий
Стационарное=постоянство параметров за счет внешних параметров (присуще жив организмам)
Процесс-переход системы из одного сост-я в др, сопровождается изменениями термодинамических параметров.
Классификация- по постоянству параметров:
А)изохорные(v=const)
B)Изобарные (давление- const)
C)изотермич-е
По знаку тепл эффекта: экзотермич-е и эндотермические
По затрате Энергии: самопроизвол, несамопроизвол
По хар-ку протекания: обратимые и необратимые
Внутренняя энергия. Энтальпия. Теплота и работа – две формы передачи энергии.
Внутренняя энергия (U)- зависящая от термодинамического состояния системы, равна сумме всех видов энергии частей системы, за исключением кинетической и потенциальной энергии как целого.
[U]=Дж
Зависит от :
Характера движения и взаимодействия частиц в системе
От природы составляющих систему в-в
От массы
От внешних условий- темп, давл, объема
Энтальпия-энергия, которой обладает система при постоянном давлении
[H]=Дж
Связь энтальпии с внутр энергией ∆H=∆U+A, A=p*∆V
=>∆H=∆U+ p*∆V
А-работа, совершаемая против дей-я внеш сил, р-давление
Стандартная энтальпия-это изменение 1 моля в-ва в стандартных условиях(Т=298К, р=101,325 кПа)
[∆H0298]=кДж/моль
Расчет изменения энтальпии в процессе хим р-ции
∆H0298(р-реакции)= ∑n∆H0298(обр-образования)- ∑n∆H0298(обрахованияисзодныхв-в)
Теплота и работа-не форма энергии, а способ ее передачи. Они не являются термическими состояниями, следовательно их величины зависит от пути процесса в отличие от U,H.G,S,F
[Q]=[A]=Дж
Дата добавления: 2018-02-28; просмотров: 863; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
