Пороговая концентрация коллоидного раствора гидроксида алюминия равняется 0,63 ммоль/л
Рассчитайте объем 0,01М раствора дихромата калия, вызывающего коагуляцию золя объёмом 200 мл.
Определите заряд гранулы, учитывая, что коагулирующим действием обладает дихромат-анион.
Предложите соответствующий вариант формулы мицеллы золя Al(OH)3.
Приведите строение мицеллы.
Решение
1.Рассчитаем объем раствора электролита-коагулятора дихромата калия (V) по формуле:
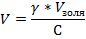
, где γ- пороговая концентрация коллоидного раствора гидроксида алюминия, равна 0,63 ммоль/л, V золя –объем золя, согласно условию равен 0,2 л, С- концентрация электролита-коагулятора дихромата калия, равна 10 ммоль/л. Подставляя значения в формулу, получаем:
V=0,63ммоль/л *0,2л/10 ммоль/л=0,0126 л=12,6 мл
2.Поскольку коагулирующим действием обладает дихромат-анион, заряд гранулы (коллоидной частицы) противоположен, т.е. положителен.
3. Соответствующий вариант формулы мицеллы золя Al(OH)3, стабилизированного AlCl3:
[m Al(OH)3 *nAl3+*3(n-x)Cl-]+x*3xCl-
4.Строение мицеллы:
Ядро - mAl (OH)3*nAl 3+; адсорбционный слой противоионов 3(n-x) Cl-; диффузный слой противоионов - 3х Cl-
3. Напишите схему реакции взаимодействия 1-бромпропана с этилатом натрия.
Опишите ее механизм.
Укажитенуклеофил, субстрат, уходящую группу.
Ответ
1. Схема реакции взаимодействия 1-бромпропана с этилатом натрия:

1. Механизм реакции: замещение нуклеофильное, бимолекулярное, SN2
Реакция происходит в одну стадию. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
|
|
|
C3H7Br + C2H5O- → [C2H5O-⋯C3H7⋯Br]− → C2H5-O-C3H7+ Br –
2. Нуклеофил - этилат-анион C2H5O-,
субстрат - 1-бромпропан, СН3СН2СН2Br,
уходящая группа - Br –
БИЛЕТ 7
Осмотические свойства растворов электролитов. Изотонический коэффициент.
Этот вопрос читай в таком темпе, чтобы я записывала и сокращала, а то не успею.
Электролиты – вещества, молекулы которых распадаются в водных растворах и расплавах с образованием заряженных частиц –ионов. К электролитам относятся все соли, щелочи, растворимые кислоты. Реальные растворы электролитов, в отличие от растворов неэлектролитов, по своим свойствам отличаются от идеальных. Так для растворов электролитов экспериментально найденные значения коллигативныххарактеристик всегда больше, чем рассчитанные по законам Вант-Гоффа и Рауля. Т.е., растворы электролитов на практике ведут себя так, как будто они содержат больше частиц растворенного вещества, чем это следует из их аналитической концентрации. Исходя из этого, Вант-Гофф предложил для растворов электролитов при теоретическом расчете Росм.,  tкип., Δtзам., использовать поправочный коэффициент i, который получил название коэффициента Вант-Гоффа или изотонического коэффициента:
tкип., Δtзам., использовать поправочный коэффициент i, который получил название коэффициента Вант-Гоффа или изотонического коэффициента:
|
|
|
Росм. = iCRT; Δtкип. = iEm; Δtзам. = iKm;
где С – молярная концентрация растворенного вещества, m- моляльная концентрация растворенного вещества, Е и К – соотвественно, эбулиоскопическая и криоскопическая константы.
Изотонический коэффициент показывает, во сколько раз реальное число частиц растворенного вещества больше чем теоретически ожидаемое (если предполагать, что вещество в растворе присутствует только в виде молекул).
Для идеальных растворов электролитов i >1.
Изотонический коэффициент показывает также, во сколько раз наблюдаемое опытное значение Росм.,Δtкип., Δtзам., больше теоретически вычисленного. Причину отклонения растворов электролитов от законов Рауля и Вант-Гоффа впервые объяснил шведский ученый С. Аррениус. Он показал, что электролиты за счет действия молекул растворителя распадаются на ионы. Этот процесс приводит к увеличению реального числа частиц растворенного вещества.
Максимально значение изотонического коэффициента (imax) для любого электролита будет при этом равно числу ионов, которые образуются при полной диссоциации его молекулы (или формульной единицы), т.к. именно во столько раз возрастет число частиц электролита в растворе.
|
|
|
Так, для NaClimax = 2, для Na3PO4imax = 4.
В реальных растворах диссоциация часто протекает не полностью, особенно если электролит является слабым. Кроме того, наблюдаются межионные взаимодействия, приводящие к уменьшению числа кинетически активных частиц. В этом случае величина i будет меньше его возможного максимального значения и будет зависеть от степени диссоциации электролита:
i = 1 + α (m - 1)
где α - степень диссоциации электролита (в долях единицы); m - число ионов, образующихся при полном распаде одной молекулы или одной формульной единицы электролита.
Таким образом, из двух растворов однотипных электролитов (т.е. распадающихся на одно и то же число ионов) с одинаковой молярной (моляльной) концентрацией изотонический коэффициент будет больше в растворе электролита с более высокой степенью диссоциации α. Соответственно и росм.,Δtкип., Δtзам. для такого раствора тоже будут иметь большие значения.Если же молярная концентрация и степень диссоциации электролитов разного типа в растворе одинаковые, то значение i будет выше для электролита, диссоциирующего на большее число ионов m.
Дата добавления: 2018-02-28; просмотров: 2172; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
