Коллигативные свойства разбавленных растворов неэлектролитов. Закон Рауля: формулировки, расчетные формулы
Коллигативные свойства- это свойства растворов относительно свойств растворителя, зависящие, главным образом, от числа растворенных частиц.
1. Давление насыщенного пара разбавленных растворов.
Насыщенный пар-пар, находящийся в равновесии с жидкостью. Давление такого пара p0 называется давлением или упругостью насыщенного пара чистого растворителя.
1 Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором нелетучего вещества равно его молярной доле.


Где p0–давление насыщенного пара растворителя над растворителем
p-давление насыщенного пара растворителя над раствором.
N-молярная доля растворенного вещества
n- количество растворенного вещества
n0количество вещества растворителя
p=p0·N0
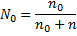
2.Давление пара идеальных и реальных растворов
Если компоненты бинарного (состоящего из двух компонентов) раствора летучи, то пар над раствором будет содержать оба компонента.

3. Температура кристаллизации разбавленных растворов ( 2 закон Рауля)
Понижение температуры замерзания растворов неэлектролитов прямо пропорционально моляльности вещества в растворе.




B(x)-моляльность вещества X в растворе , моль/кг
x-формула растворенного вещества
 -криоскопическая константа растворителя (у воды=1,86 кг*К*моль-1
-криоскопическая константа растворителя (у воды=1,86 кг*К*моль-1
4. Температура разбавления растворов –температура, при которой давление насыщенного пара становится равным внешнему давлению.( формулу можешь не повторять, просто напомни, что она есть)




5. Осмотическое давление
Осмос-преимущественно одностороннее прохождение молекул растворителя через полупроницаемую мембрану в раствор или молекул растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией.
Закон Вант-Гоффа: Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации растворенного вещества.
P=C(x) * R * T


P-осм.давление
С(x)-молярная концентрация вещества X
R-универ-ая газовая постоянная =8,31 л*кПа*моль-1* К-1
Т-абсолютная температура=t+273
3)Объясните, в каком соединении – хлорбензоле или бензилхлориде (фенилхлорметане) – галоген является частью сопряженной системы. Назовите вид сопряжения.Изобразите графически дополнительное перекрывание электронных орбиталей, приводящее к образованию сопряженной системы.

Галоген является частью сопряженной системы в хлорбензоле, поскольку в бензилхлориде его отделяет от бензольного кольца метиленовый мостик СН2. Вид сопряжения – р-π. В сопряжении участвуют 3р- электроны хлора и π-система бензольного кольца.
Дата добавления: 2018-02-28; просмотров: 1941; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
