Гетерогенные химические реакции. Влияние температуры на протекание гетерогенной химической реакции
Увеличение скорости химической реакции с ростом температуры, на первый взгляд, можно объяснить возрастанием скорости теплового движения молекул исходных веществ. Это должно приводить к увеличению числа соударений между ними, несмотря на то, что общее количество молекул осталось неизменным.
Однако, как показали расчёты, число соударений между частицами, находящимися в газовых и жидких средах за единицу времени, всегда достаточно велико. Так, в 1 см3 газа (при н.у.) за одну секунду происходит ~ 1 · 1028 столкновений между молекулами. Если бы каждое из них приводило к образованию конечных продуктов, то подавляющее большинство химических реакций протекали бы практически мгновенно, т.е. со взрывом.
На практике этого не наблюдается, т.к. не все соударения между молекулами исходных веществ являются «успешными». Установлено, что для многих реакций число таких «успешных» соударений ~ в 1015–1020 раз меньше, чем общее число соударений.
Протекание реакции становится возможным только в том случае, если столкнувшиеся молекулы обладают достаточным запасом внутренней энергии. Если её значение равно какой-то определённой величине или больше её, то реакция осуществится (в противном случае – нет). Такие молекулы называются активными, а соударения между ними – эффективными.
Обычно доля активных молекул реагентов, по сравнению с их общим числом, для большинства реакций невелика.
При повышении температуры увеличивается запас внутренней энергии молекул. Всё большее их число становятся активными. Как следствие этого, возрастает доля эффективных соударений между молекулами за единицу времени, а значит и скорость химической реакции.
При повышении температуры концентрации исходных веществ в реакционной смеси практически не изменяются. Значит, увеличение скорости реакции в соответствии с главным кинетическим уравнением должно быть связано с возрастанием её константы скорости.
Голландский учёный Вант-Гофф опытным путём определил, что для химических реакций (имеющих нормальный тип зависимости скорости от температуры) при повышении температуры на каждые 10 градусов величина константы скорости возрастает в 2-4 раза. Причём для каждой химической реакции это число является постоянным и может принимать из указанного интервала как целочисленные (2, 3, 4) значения, так и дробные. Оно определяется экспериментально, называется температурным коэффициентом скорости химической реакции или коэффициентом Вант-Гоффа и обозначается греческой буквой γ:

Более точную зависимость константы скорости от температуры дает уравнение Аррениуса:
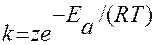 или lnk=B-А/Т по графику lg от 1/Т находят В и А:
или lnk=B-А/Т по графику lg от 1/Т находят В и А:
lnk=lnz - Ea/RT
|
Энергия активации – избыток энергии по сравнению со средней энергией реагирующих веществ, который необходим для того, чтобы соударения были результативными.
Гомогенный катализ.
Гомогенные каталитические реакции широко распространены в природе. Примером промышленных гомогенных каталитических процессов может служить реакция этерификации, омыления сложных эфиров и т. д.
Механизм каталитического действия при гомогенном катализе заключается в образовании между реагирующими соединениями и катализатором промежуточных соединений, которые в некоторых случаях удается даже выделить. Ускорение реакции в большинстве случаев проходит за счет снижения энергии активации. При гомогенном катализе в растворах каталитическое действие могут оказывать ионы водорода, гидроксила, солей, а также веществ, способствующих образованию свободных радикалов.
Катализ под действием ионов водорода или гидроксила называют кислотно – основным. Этот вид катализа наиболее распространен. Сущность его заключается в переходе протона от катализатора к реагирующему веществу (катализ кислотами) или от реагирующего вещества к катализатору (катализ основаниями). В дальнейшем протон перемещается в обратном направлении и катализатор регенерируется.

На скорость гомогенных каталитических реакций влияют многие факторы: активность катализатора, температура, концентрация катализатора, перемешивание. Скорость многих каталитических реакций зависит от концентрации катализатора. При малых значениях Скат выход продукта Х за данный период времени примерно пропорционален концентрации катализатора, но при дальнейшем повышении Скат кривая переходит в затухающую
Жидкофазные каталитические реакции обычно осуществляют в реакторах с перемешивающими устройствами.
Ферментативный катализ.
Ферментативный катализ – каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы. Ферментативный катализ имеет две характерные особенности:
1. Высокая активность, на несколько порядков превышающая активность неорганических катализаторов, что объясняется очень значительным снижением энергии активации процесса ферментами. Так, константа скорости реакции разложения перекиси водорода, катализируемой ионами Fе2+, составляет 56 с-1; константа скорости этой же реакции, катализируемой ферментом каталазой, равна 3.5·107, т.е. реакция в присутствии фермента протекает в миллион раз быстрее (энергии активации процессов составляют соответственно 42 и 7.1 кДж/моль). Константы скорости гидролиза мочевины в присутствии кислоты и уреазы различаются на тринадцать порядков, составляя 7.4·10-7 и 5·106 с-1 (величина энергии активации составляет соответственно 103 и 28 кДж/моль).
2. Высокая специфичность. Например, амилаза катализирует процесс расщепления крахмала, представляющего собой цепь одинаковых глюкозных звеньев, но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного фрагментов.
Согласно общепринятым представлениям о механизме ферментативного катализа, субстрат S и фермент F находятся в равновесии с очень быстро образующимся фермент-субстратным комплексом FS, который сравнительно медленно распадается на продукт реакции P с выделением свободного фермента; т.о., стадия распада фермент-субстратного комплекса на продукты реакции является скоростьопределяющей (лимитирующей).
F + S <––> FS ––> F + P
Исследование зависимости скорости ферментативной реакции от концентрации субстрата при неизменной концентрации фермента показали, что с увеличением концентрации субстрата скорость реакции сначала увеличивается, а затем перестает изменяться (рис. 2.12) и зависимость скорости реакции от концентрации субстрата описывается следующим уравнением:
 (II.45)
(II.45)
Здесь Кm – константа Михаэлиса, численно равная концентрации субстрата при V = ½Vmax. Константа Михаэлиса служит мерой сродства между субстратом и ферментом: чем меньше Кm, тем больше их способность к образованию фермент-субстратного комплекса.
Характерной особенностью действия ферментов является также высокая чувствительность активности ферментов к внешним условиям – рН среды и температуре. Ферменты активны лишь в достаточно узком интервале рН и температуры, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значении рН или температуры; по обе стороны от этого значения активность ферментов быстро снижается.

Рис. 2.12 Зависимость скорости ферментативной реакции от концентрации субстрата.
Гетерогенный катализ.
Основным недостатком гомогенного катализа является трудность выделения катализатора из конечной реакционной смеси, в результате чего часть катализатора теряется безвозвратно, с продукт загрязняется им. Поэтому значительно большее распространение получил гетерогенный катализ.
По фазовому признаку известны различные виды гетерогенного катализа: жидкие катализаторы, ускоряющие реакции между несмешивающимися жидкостями (или жидкостями и газами) и твердые катализаторы, ускоряющие реакции между жидкостями или газами. Большинство каталитических реакций - это реакции газов с участием твердых катализаторов. Из существующих теорий катализа общим для всех теорий является образование на поверхности твердого катализатора промежуточного соединения адсорбционного типа с участием электронов катализатора.
Катализаторы, как правило, представляют собой пористые твердые тела, имеющие высокоразвитую внутреннюю поверхность. Весь каталитический процесс на твердом пористом катализаторе можно представить в виде пяти самостоятельных стадий:
1. Диффузия реагирующих веществ из потока к поверхности зерна катализатора и внутри пор, имеющихся в зерне.
2. Активированная адсорбция (хемосорбция) на поверхности катализатора с образованием промежуточных поверхностных соединений реагент - катализатор.
3. Перегруппировка атомов с образованием промежуточного соединения продукт – катализатор.
4. Десорбция продукта с поверхности катализатора.
5. Диффузия продукта с поверхности катализатора сначала внутри пор, а затем с поверхности зерна в общий поток.
Общая скорость суммарного каталитического процесса лимитируется самой медленной из стадий. Если этой стадией является один из диффузионных этапов, то катализ проходит в диффузионной области. Причем различают внешне- и внутридиффузионные области. Если медленными являются 2, 3 или 4 стадия, то процесс идет в кинетической области.
Общее уравнение скорости каталитического процесса, протекающего в каталитической области,
 ,
,
где  - приращение количества продукта во времени;
- приращение количества продукта во времени;
k0 – предэкспоненциальный множитель в уравнении Аррениуса;
V – насыпной объем катализатора;
е – основной натуральный логарифм;
ΔС – движущая сила процесса при атмосферном давлении;
Р1 – безразмерное давление, т. е. отношение действительного давления к атмосферному;
n – порядок реакции.
В кинетической области протекают процессы на малоактивных катализаторах с мелкими размерами зерен и крупными порами при турбулентном режиме потока реагентов и невысоких температурах.
Если процесс идет во внешнедиффузионной области, то скорость определяется коэффициентом диффузии реагентов и продуктов реакции. По закону Фика
 ,
,
где Dэ – эффективный коэффициент диффузии;
S – свободная поверхность зерен катализатора;
Z – направление, перпендикулярное поверхности.
Во внешнедиффузионной области проходят процессы на активных катализаторах. Для ускорения процесса применяют высокие скорости потока.
Во внутридиффузионной области общая скорость каталитического процесса лимитируется скоростью диффузии реагентов и продуктов реакции в порах зерен катализатора. Каталитические процессы во внутридиффузионной области можно ускорить уменьшением зерен катализатора и увеличением радиуса пор, но при этом сокращается их количество и соответственно поверхность.
Дата добавления: 2018-02-28; просмотров: 1664; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
