Применение теории активного комплекса к реакциям в растворе
Теория абсолютных скоростей реакций, строго говоря, применима только для рассмотрения реакций в идеальных газах, когда исходные частицы и активированный комплекс можно рассматривать изолированно от окружающей среды.
В растворе образование активированного комплекса из исходных частиц сопровождается теми или иными изменениями молекулярных взаимодействий реагирующих частиц с молекулами растворителя.
Жидкое состояние вещества является промежуточным между твердым и газообразным. Отличаясь от газа и твердого тела, жидкость имеет черты сходства с каждым из этих состояний.
Применение теории активированного комплекса к кинетике реакций в растворах
Для применения этой теории к жидкости необходимо учесть межмолекулярные взаимодействия исходных частиц и активированного комплекса с молекулами окружающей среды.
Рассмотрим уравнение переходного состояния:
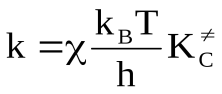 .
.
Раствор нельзя считать идеальным, так как имеется межмолекулярное взаимодействие, поэтому необходимо вместо Kcввести Ka: 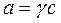 ;
;
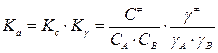 ,
,
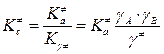 ,
,
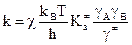 .
.
При γ = 1 система идеальная.
Если перейти к изобарному потенциалу, то
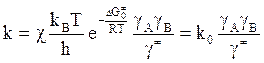 ,везде - это 1
,везде - это 1
где 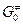 – изобарный потенциал при активности, равной единице.
– изобарный потенциал при активности, равной единице.
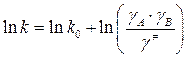 ,
,
k0– константа скорости в среде, для которой коэффициенты активности исходных частиц и активированного комплекса приняты равными единице.
Это соотношение называется уравнением Бренстеда-Бьеррума. Данное уравнение в принципе решает вопрос о влиянии среды на скорость элементарной химической реакции, сводя задачу к определению коэффициента активности исходных веществ и активированного комплекса. Однако в то время как существует ряд методов, позволяющих измерить коэффициент активности исходных веществ, величину g¹не удается экспериментально измерить из независимых данных. Поэтому уравнение Бренстеда-Бьеррума имеет лишь теоретическое значение.
|
|
|
86 Цепные реакции(см. лекции). Крекинг нефти
Крекинг нефтепродуктов
Крекинг – расщепление УВ с длинной цепью и образование УВ с меньшим числом атомов. Разработан Шуховым 1890 г.
Крекинг бывает: термический и каталитический.
Химизм крекинга
Крекинг – это сложный химический процесс, так как сырьем является смесь различных УВ. Наименее устойчивыми к нагреванию являются парафины, наиболее устойчивыми – нафтены и ароматические УВ.
При температуре 450-550̊С идет распад молекулы парафина с разрывом связи по середине цепи с образованием предельного УВ и непредельного:
С16H34 → C8H18 +C8H16
С8H18 → C4H10+C4H8
У низших парафинов наблюдается дегидрирование:
С4H10 → C4H8+H2
Превращение нафтенов протекает следующим образом:
1. Разрыв боковых цепей (как у парафинов);
|
|
|
2. Дегидрирование шестичленных нафтенов с образованием ароматических УВ:

У ароматических УВ преобладают реакции конденсации, что приводит к образованию УВ с большим числом бензольных колец, а также разрыв боковых цепей у гомологов бензола.
Превращение олефинов:
1. Полимеризация с образованием олефинов >Mm и разветвленной углеродной цепью.
2. Реакции распада с образованием диенового УВ и парафина:
CH2=CH-CH2-CH2-CH3 → CH2=CH-CH-CH2 + CH4
или: С8H16 →2С4H8
3. Конденсация с диеновыми УВ:
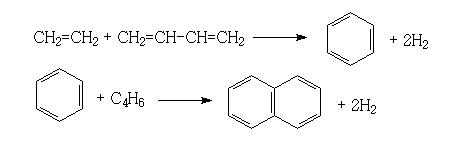
Таким образом, при крекинге:
1). В результате распада УВ образуются вещества с меньшей молекулярной массой и низкой tкип., и наряду с бензиновой фракцией получается газ крекинга.
2). В результате реакций конденсации образуются вещества с большей, чем у исходных УВ, молекулярной массы – входящие в состав неперегоняющегося остатка (крекинг - остаток) и кокса.
Каталитический крекинг
Катализатор – алюмосиликат -ускоряет крекинг, что позволяет провести его в более мягких условиях (при 450—500° С и давлении 1,5—2 ат).
Сырьем являются широкая фракция с т. кип. 350—500° С, получаемая перегонкой в вакууме мазута, и газойль-соляровая фракция из установок термического крекинга и коксования. Сырье полностью испаряется, и пары его подвергаются крекингу на поверхности катализатора — искусственно полученного алюмосиликата (в виде мелких шариков или пыли) или цеолита.
|
|
|
Под влиянием катализатора наряду с рассмотренными выше реакциями распада, полимеризации и конденсации углеводородов интенсивно протекают также процессы, не наблюдающиеся при термическом крекинге: изомеризация олефинов, приводящая к разветвлению углеродной цепи; перераспределениеводорода (отщепление его от соединений, вступающих в реакции конденсации с постепенным образованием кокса, отлагающегося на поверхности катализатора, неприсоединение отщепляющегося водорода к непредельным углеводородам). Поэтому бензин каталитического крекинга почти не содержит непредельных углеводородов; содержание в немароматических углеводородов, нафтенов и изопарафинов выше, чем в бензине термического крекинга. Этот бензин вне независимости от состава сырья имеет октановое число 77-80 без добавки этиловой жидкости; выход его составляет 30—35%; кроме того, из паров выделяется 25—30% газойля, который по составу значительно отличается от исходного газойля, вследствие чего не может быть использован для каталитического крекинга и вводится в дизельное топливо. Образуется также тяжелая фракция (13-20%), которую вводят в котельное топливо; количество газа крекинга (12-20%) и кокса (8%) значительно больше, чем при термическом крекинге.
|
|
|
87. разветвленные цепные реакции. Горение. Взрыв. (см. лекции)
Цепная реакция является разветвленной, если в ней протекает такая стадия, в которой один радикал или атом генерирует образование нескольких атомов и радикалов. В результате при благоприятных условиях в ходе реакции нарастает концентрация активных центров и, соответственно, увеличивается скорость реакции. Это часто приводит к воспламенению или взрыву. Если разветвление происходит в результате взаимодействия атома (радикала) с молекулой, то в силу сохранения нечетного числа электронов в радикальных реакциях в системе из одной возникают 3 частицы с неспаренным электроном (в общем случае 2n + 1). Увеличение числа частиц может происходить в одну стадию; например, в цепной реакции распада NСl3 оно идет по схеме:
88. Понятие о фотохимических и радиационных химических реакциях.(см. лекции)
Дата добавления: 2018-02-28; просмотров: 959; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
