Кинетические уравнения необратимых реакций 1-го и 2-го порядков
Й порядок
Если обозначить концентрацию в каждый момент времени  через С, то при постоянной температуре скорость реакции будет:
через С, то при постоянной температуре скорость реакции будет:
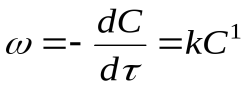
Разделив переменные и проинтегрировав уравнение, получим:

При  постоянная интегрированияconst=lnС0, тогда:
постоянная интегрированияconst=lnС0, тогда:
 (1)
(1)

Кинетическое уравнение реакции второго порядка:

Если 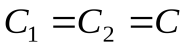 , то
, то  .
.
 . Разделим переменные и проинтегрируем:
. Разделим переменные и проинтегрируем:  и получим:
и получим:
 уравнения реакций второго порядка
уравнения реакций второго порядка
Кинетические уравнения реакций 3-го и n-го порядков?
 - - уравнение n-го порядка
- - уравнение n-го порядка
- Основное кинетическое уравнение для реакции третьего порядка имеет вид:

Если  , уравнение примет вид:
, уравнение примет вид:  .
.




79. Определение порядка реакции. (см. лекции)
80 Энергия активации. Зависимость константы скорости химической реакции от температуры. (см. лекции)
81.Последовательные, параллельные и сопряженные химические реакции.
Последовательные реакции.
Последовательными называются сложные реакции, протекающие таким образом, что вещества, образующиеся в результате одной стадии (т.е. продукты этой стадии), являются исходными веществами для другой стадии. Схематически последовательную реакцию можно изобразить следующим образом:
А ––> В ––> С ––> ...
Число стадий и веществ, принимающих участие в каждой из стадий, может быть различным.
Параллельные реакции.

Параллельными называют химические реакции, в которых одни и те же исходные вещества одновременно могут образовывать различные продукты реакции, например, два или более изомера:
|
|
|
Сопряженные реакции.
Сопряженными принято называть сложные реакции, протекающие следующим образом:
1) А + В ––> С
2) А + D ––> Е,
причем одна из реакций может протекать самостоятельно, а вторая возможна только при наличии первой. Вещество А, общее для обеих реакций, носит название актор, вещество В – индуктор, вещество D, взаимодействующее с А только при наличии первой реакции – акцептор. Например, бензол в водном растворе не окисляется пероксидом водорода, но при добавлении солей Fe(II) происходит превращение его в фенол и дифенил. Механизм реакции следующий. На первой стадии образуются свободные радикалы:
Fe2+ + H2O2 ––> Fe3+ + OH– + OH•
которые реагируют с ионами Fe2+ и бензолом:
Fe2+ + OH• ––> Fe3+ + OH–
C6H6 + OH• ––> C6H5• + H2O
Происходит также рекомбинация радикалов:
C6H5• + OH• ––> C6H5ОН
C6H5• + C6H5• ––> C6H5–C6H5
Т.о., обе реакции протекают с участием общего промежуточного свободного радикала OH•.
82. Теория активных соударений(переходного состояния), стерический фактор.
Основные предпосылки:
1. Молекулы представляют в виде шариков.
2. Для того, чтобы произошло взаимодействие, необходимо столкновение.
3. Процесс протекает только в том случае, если энергия столкновения больше или равна определенному значению энергии, которая называется энергией активации.
|
|
|
Дата добавления: 2018-02-28; просмотров: 833; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
