Вывод основного уравнения ТАК
Скорость процесса определяется скоростью прохождения активированным комплексом расстояния 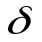 .
.

Обозначим:
 – время жизни активированного комплекса.
– время жизни активированного комплекса.
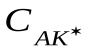 – концентрация активированного комплекса.
– концентрация активированного комплекса.
 , где
, где 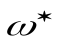 – средняя скорость прохождения АК через барьер.
– средняя скорость прохождения АК через барьер.
 , где
, где
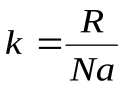 – константа Больцмана;
– константа Больцмана;
 –масса комплекса; Т – температура, К.
–масса комплекса; Т – температура, К.
Тогда время жизни комплекса равно:

Скорость процесса:  . Подставим в это выражение значение времени жизни комплекса
. Подставим в это выражение значение времени жизни комплекса  :
:
 – скорость реакции.
– скорость реакции.
В уравнение вводится трансмиссионный коэффициент  , показывающий, какая доля активированных комплексов переходит в продукты реакции.
, показывающий, какая доля активированных комплексов переходит в продукты реакции.

Рассмотрим бимолекулярную реакцию с позиции ТАК:
А+В  АВ
АВ  → АВ
→ АВ
Скорость процесса описывается кинетическим уравнением второго порядка:  .
.
Выразим константу скорости:
 – выражение константы равновесия.
– выражение константы равновесия.
Константу равновесия процесса образования продуктов реакции и исходных веществ можно представить следующим образом:
 , где
, где
к* – константа равновесия процесса образования активированного комплекса;
h– постоянная Планка.
Подставим это выражение в выражение константы скорости бимолекулярной реакции:
 уравнение Эйринга
уравнение Эйринга
Это уравнение позволяет связать кинетические параметры с термодинамическими.
1. Вводится понятие теплоты и энтропии активации.
2. С помощью этого уравнения можно рассчитать абсолютные скорости химического процесса.
Физический смысл энтропии активации.
Энтропия активации S* – это изменение энтропии при образовании активированного комплекса.

∆S* не связана с ∆Sреакции.
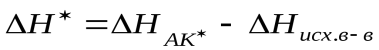 (энтальпии активации)
(энтальпии активации)
Константа скорости реакции может быть выражена через термодинамические параметры:

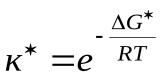

 – подставим это выражение в уравнение Эйринга
– подставим это выражение в уравнение Эйринга
 основное уравнение ТАК
основное уравнение ТАК
Сопоставление теории активного комплекса и активных соударений.
Скорость реакции, согласно теории переходного состояния, зависит от двух факторов:
1) энергетического фактора – Н, энтальпии активации (чем больше энтальпия активации, тем меньше скорость реакции);
2) энтропийного фактора – S, энтропии активации (чем больше энтропия активации, тем больше скорость реакции).
Учёт энтропийного фактора позволил установить связь константы скорости со строением молекул реагирующих веществ. При этом теория ПС оперирует, в частности, величинами расстояний между атомами в молекулах, взаимной ориентацией молекул, ᴛ.ᴇ. параметрами геометрического характера.
Теория активных соударений позволяет при знании энергии активации рассчитать общее число эффективных соударений и отсюда скорость реакции, не объясняя механизма реакции. В отличие от теории активных соударений теория ПК сопоставляет различные возможные комплексы, выявляет большую или меньшую их достижимость и определяет в результате энергетически наиболее выгодный путь реакции.
Для вычисления скоростей взаимодействия двух атомов две теории дают одинаковые результаты. В случае нелинœейных многоатомных молекул теория ПК дает значение скоростей, отличных от значений, которые дает теория соударений. В случае если известна конфигурация реагирующих молекул и активного комплекса, теория ПК позволяет рассчитать предэкспоненциальный множитель. К сожалению, в большинстве случаев строение активированного комплекса и его свойства неизвестны и это затрудняет расчёты.
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, две теории дополняют друг друга. Теория ПК применяется для вычисления абсолютных скоростей электродных процессов, процессов диффузии и т. д. Теория активных соударений хорошо описывает, как правило, реакции в газовой среде.
Дата добавления: 2018-02-28; просмотров: 1813; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
