Типы электродов, используемых в электрохимических методах анализа
Различают обратимые и необратимые электроды. При перемене направления электрического тока на обратимых электродах возникают реакции, противоположные по направлению, на необратимых - протекают реакции не обратные друг другу. При электролизе на необратимых электродах выделяются устойчивые двухатомные газы, как, например, водород и кислород.
Примером обратимого электрода служит медь в растворе, содержащем Cu2+. При прохождении тока в противоположных направлениях идут реакции:
Cu2+ + 2e®Cu и Cu®Cu2+ + 2e.
К необратимым электродам относится, например, медь в растворе кислоты. Перемена направления тока приводит к реакциям
2H+ + 2e ® H2 и Cu® Cu2+ + 2e.
Из обратимых электродов могут быть составлены обратимые электрохимические цепи (пары, гальванические элементы).

Классификация обратимых электродов
Электроды первого рода - любой металл, погруженный в раствор соли этого же металла. Образует окислительно-восстановительную систему, в которой потенциал электрода определяется относительно концентрации катионов в растворе. К электродам первого рода относятся ртутные, серебряные, платиновые, водородные и другие.
Электроды второго рода - система, в которой металл, покрытый слоем его труднорастворимого соединения (соли, оксида или гидроксида), находится в равновесии с раствором, содержащим избыток другой хорошо растворимой соли с таким же анионом. Потенциал такого электрода определяется концентрацией соответствующего аниона. К электродам второго рода относятся хлорид-серябряный, каломельный и сурьмяный электроды, часто применяемые в качестве электродов сравнения.
|
|
|
Окислительно-восстановительные электроды - инертное вещество с электронной проводимостью (например, платина), погруженное в раствор, содержащий вещества с различной степенью окисления Red и Ox. В качестве электродов этого типа чаще всего применяют платиновую или серебряную проволоку, помещенную в стеклянный корпус. Инертный электрод выполняет только функцию переноса электронов от восстановленной формы к окисленной.
Ионообменные электроды. Ионообменный электрод состоит из двух фаз: ионита и раствора, а потенциал на границе раздела фаз возникает за счет ионнообменного процесса, в результате которого на поверхности ионита и раствора приобретают электрические заряды противоположного знака.К этой группе относится стеклянный электрод.
Связь ЭДС электрохимического элемента с термодинамическими характеристиками электрохимической реакции.
Термодинамика устанавливает связь между ЭДС гальванического элемента и термодинамическими характеристиками токообразующей реакции.
|
|
|
ЭДС гальванического элемента (Е) есть разность равновесных потенциалов электродов при разомкнутой внешней цепи. Если токообразующий процесс проходит в обратимых условиях, то гальванический элемент производит максимальную работу Аmах, которая равна убыли энергии Гиббса токообразующей реакции:
Amax=nFE =-ΔGp=SΔGкон - SΔGнач, ??
где nF- заряд моля вещества,
Е - работа по переносу единицы заряда.
Производная Аmах по температуре может быть выражена как
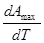 = nF
= nF 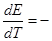
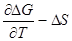 .??
.??
Значения же ΔG и ΔS связаны с ΔН уравнением Гиббса-Гельмгольца:
ΔН =ΔG + TΔS, или ΔG=ΔH-TΔS. Таким образом, по известным ΔH,ΔG,ΔS токообразующей реакции можно просто рассчитать ЭДС гальванического элемента и ее температурную зависимость.
Часто применяется и обратное решение - по величине ЭДС обратимо работающего гальванического элемента и ее температурной зависимости рассчитывают термодинамические характеристики токообразующих реакций и участвующих в них веществ.
ЭДС гальванического элемента равна разности потенциалов электродов лишь для простых электрохимических систем (без диафрагмы):
(-) Me1/Me1A, Me2A/Me2(+)
В сложных системах появляется диффузионный потенциал (десятки милливольт)
|
|
|
jдиф = S(t+- t-) 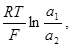
т. е., чтобы оценить величину диффузионного потенциала, надо знать t+ и t- - числа переноса катионов и анионов и активности ионов по обеим сторонам диафрагмы (a1, a2).
ЭДС гальванического элемента может быть рассчитана и как разность электродных потенциалов. Учение об электродном потенциале является основой электрохимии.
Дата добавления: 2018-02-28; просмотров: 1745; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
