Скорость и подвижность ионов. Числа переноса. Закон Кольрауша. Закон разведения Оствальда
Скорость направленного движения иона, т. е. путь, пройденный ионом в растворе под действием электрического поля в направлении к электроду за единицу времени, зависит от действующей на ион силы, т. е. от напряженности электрического поля:
v=u•Е
где V — скорость движения иона, м/с; Е - напряженность поля, В/м;u - коэффициент пропорциональности, называемый электрической подвижностью иона или просто подвижностью иона, м2/(В • с).
Подвижность иона характеризует его способность преодолевать сопротивление среды при направленном движении в электрическом поле.
Вследствие различной подвижности ионов количество электричества, переносимое катионами и анионами электролита, различно. Числом переносаti называют долю тока, которая переносится данным сортом ионов:
 . (17.32)
. (17.32)
Из уравнений (17.7), (17.8) и (17.15) получим для бинарного электролита:
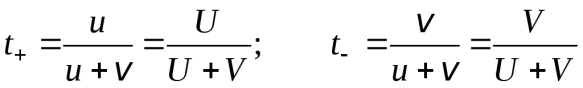 . (17.33)
. (17.33)
Как видно из этих выражений, число переноса данного сорта ионов зависит от подвижности обоих ионов и характеризует не отдельно взятый вид ионов, а весь электролит в целом. Так как подвижности ионов зависят от концентрации, то от нее зависят и числа переноса.
На основании экспериментальных данных установлено, что если число переноса иона близко к 0,5, то оно мало зависит от концентрации, при t+< 0,5 оно понижается с ростом концентрации (t–> 0,5 растет), а приt–> 0,5 – повышается (t+<0,5 понижается). Числа переноса, как и подвижности, меняются с температурой, однако в меньшей степени, так как числа переноса зависят от отношения подвижностей.
|
|
|
В соответствии с законом Ф.В.Г.Кольрауша(1879):
В бесконечно разбавленном растворе ионы движутся независимо один от другого,
величина l∞ может быть вычислена как сумма предельных ионных электрических проводимостей (подвижностей ионов):
l∞ = lк + lа (9.3)
где lк и lа - подвижность катиона и аниона соответственно.
Подвижность ионовсвязана с абсолютной скоростью их движения v выражением
lк =Fvк и lк =Fvк .
где F - число Фарадея.
Закон разведения Оствальда
Константа диссоциации слабого электролита связана со степенью диссоциации. Обозначим: С – исходная концентрация электролита, α – степень диссоциации. Тогда концентрация ионов в состоянии равновесия для бинарного электролита Сα. Концентрация недиссоциированных молекул будет
(С – С∙α) = С (1–α).
Константу диссоциации для уксусной кислоты можно представить следующим образом:
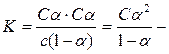 закон разведения Оствальда.
закон разведения Оствальда.
В слабых электролитах величина α << 1. Поэтому значением α можно пренебречь и величину (1-α) принять равной 1. Тогда K=Cα2, 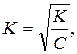 (Перед = не К, а альфа)т.е. степень диссоциации слабых электролитов обратно пропорциональна квадратному корню из концентрации.
(Перед = не К, а альфа)т.е. степень диссоциации слабых электролитов обратно пропорциональна квадратному корню из концентрации.
|
|
|
Таким образом, закон разбавления Оствальда формулируется следующим образом: степень диссоциации электролита при разбавлении раствора увеличивается.
Дата добавления: 2018-02-28; просмотров: 4066; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
