Приложение 5. Определение коэффициентов функциональной зависимости 3 страница
2) f 0 = 4.5×10–11 кг/с, f = 5.2×10–11 кг/с
3) d x /d t = 9.36×10–5 см/с; D t = 3.82 ×103 с
Пример 6. (Тема: осмос) Для растворов узкой фракции полиизобутилена в бензоле были измерены осмотические давления в зависимости от концентрации при нескольких температурах (таблица ниже). Определите по этим данным молярную массу фракции и, приблизительно, значение тэта-температуры.
| с, г/л | 2.097 | 4.194 | 6.02 | 10.05 | 14.89 | 29.84 |
| p, мм рт. ст., 20 °С | 0.379 | 0.755 | 1.055 | 1.660 | 2.366 | 4.250 |
| p, мм рт. ст., 30 °С | 0.397 | 0.840 | 1.202 | 2.014 | 3.123 | 6.981 |
| p, мм рт. ст., 40 °С | 0.420 | 0.870 | 1.286 | 2.258 | 3.659 | 9.246 |
Решение. Уместно коротко остановиться на происхождении уравнения, по которому решается эта задача. Известно, что осмотическое давление идеальных растворов следует уравнению Вант-Гоффа:
p = СRT = cRT / M (1)
где С – молярная концентрация, с – весовая концентрация (масса растворённого вещества в единице объёма раствора). Это уравнение имеет близкую аналогию с уравнением состояния идеального газа, которое для n молей газа имеет вид
pV = nRT или p = 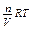 (2)
(2)
Поскольку n / V = C (число молей в единице объёма), то аналогия очевидна:
p = CRT = cRT / M (2a)
Оба уравнения применимы к реальным системам (растворам и газам, соответственно) при очень низких концентрациях или давлениях и являются универсальными. То есть, они применимы к растворам и газам любых веществ, при условии их очень низкой концентрации. При этом условии расстояние между молекулами так велико, что они не могут взаимодействовать между собой посредством межмолекулярных сил. С увеличением концентрации начинают проявляться межмолекулярные взаимодействия между молекулами растворённого вещества в растворе или молекулами газа в газообразном состоянии и, соответственно, растут отклонения от идеальных законов. Поскольку у разных веществ межмолекулярные взаимодействия имеют разную природу и интенсивность, универсального уравнения состояния для неидеальных газов не существует. Однако, многие реальные газы при умеренных давлениях (или концентрациях) следуют так называемому вириальному уравнению состояния:
|
|
|
 или
или  , (3)
, (3)
где А 2, А 3… называются вторым, третьим и т.д. вириальными коэффициентами, тогда как первый вириальный коэффициент равен 1. При малых С все члены ряда, содержащие С, малы по сравнению с 1 и уравнение (3) обращается в уравнение идеального газа (2). С увеличением концентрации относительная важность членов АnCn –1 увеличивается. Вириальные коэффициенты описывают неидеальность газа. Для данного газа они не зависят от концентрации (или давления), но зависят от температуры, так как температура влияет на интенсивность межмолекулярных взаимодействий. При высоких температурах они положительны, а при низких – отрицательны. При некоторой промежуточной температуре, которую называют точкой Бойля, они равны нулю, так что газ при этой температуре ведёт себя идеально в широком диапазоне давлений.
|
|
|
Коллоидные растворы (лиофобные золи и растворы полимеров) имеют высокую молярную массу частиц, из-за чего их осмотическое давление мало в сравнении с растворами низкомолекулярных веществ (таких как сахароза) при сравнимых весовых концентрациях. Вследствие этого, их осмотическое давление приходится измерять в области концентраций, где законы идеальных растворов не применимы. Как оказалось, термодинамические свойства таких растворов, включая осмотическое давление, подчиняются уравнениям, содержащим вириальный ряд, наподобие вириального уравнения реальных газов (3). В частности, осмотическое давление следует уравнению:
 или
или  . (4)
. (4)
У большинства растворов полимеров при низких концентрациях третий и следующие вириальные члены не проявляются. Поэтому для большинства задач достаточно пользоваться уравнением
 (4а)
(4а)
или  (4б)
(4б)
где В2 = RTA 2
По аналогии с газами, второй вириальный коэффициент не зависит от концентрации, но зависит от многих других условий. В частности, он обычно положителен при высоких температурах и отрицателен при низких. Температура, при которой он равен нулю, называется тэта-температурой (Q-температурой).
|
|
|
В настоящей задаче требуется найти молярную массу полимера и тэта-температуру по одному из этих уравнений. Решение подсказывает форма уравнений (4а) и (4б). Если обе части поделить на концентрацию, то правая часть (4б) станет линейной относительно с:
 .
.
Поэтому для каждой температуры график в координатах с – p / с должен получиться линейным, что даёт возможность найти RT / M и В 2 обычными методами, как описано в приложении 5.
|
|
 Одной из трудностей в решении задач на осмотическое давление являются единицы измерения. Долгое время осмотическое давление было принято выражать в г/см2 (СГС) или в единицах высоты столба манометрической жидкости. Однако для решения задач удобнее переводить все единицы в СИ. В условии данной задачи давление дано в мм рт. ст. 1 мм рт. ст. равен 133.322 Па. Соответственно, в таблице 1 (ниже) давления переведены в паскали и затем вычислены отношения p / с для трёх температур. На рис. (справа) показаны три графика в одних координатах. Из графика получаются результаты для трёх температур, показанные в таблице 2, где введены обозначения а = RT / M и b = B 2, и вычислено M = RT / a и A 2 = b / RT. Из этих результатов видно, что при всех трёх температурах молярная масса получается практически одинаковой, со средним значением 1.01×105 г/моль. Из рисунка видно, что коэффициент наклона графиков b увеличивается с увеличением температура от отрицательного значения при 20 °С (убывающий линейный график) до положительных значений (возрастающие графики при 30 и 40 °С), причем вторые вириальные коэффициенты приблизительно равны по абсолютной величине при 20 и 30 °С. Из этого следует, что Q-температура, при которой А 2 = 0, находится приблизительно при 25 °С.
Одной из трудностей в решении задач на осмотическое давление являются единицы измерения. Долгое время осмотическое давление было принято выражать в г/см2 (СГС) или в единицах высоты столба манометрической жидкости. Однако для решения задач удобнее переводить все единицы в СИ. В условии данной задачи давление дано в мм рт. ст. 1 мм рт. ст. равен 133.322 Па. Соответственно, в таблице 1 (ниже) давления переведены в паскали и затем вычислены отношения p / с для трёх температур. На рис. (справа) показаны три графика в одних координатах. Из графика получаются результаты для трёх температур, показанные в таблице 2, где введены обозначения а = RT / M и b = B 2, и вычислено M = RT / a и A 2 = b / RT. Из этих результатов видно, что при всех трёх температурах молярная масса получается практически одинаковой, со средним значением 1.01×105 г/моль. Из рисунка видно, что коэффициент наклона графиков b увеличивается с увеличением температура от отрицательного значения при 20 °С (убывающий линейный график) до положительных значений (возрастающие графики при 30 и 40 °С), причем вторые вириальные коэффициенты приблизительно равны по абсолютной величине при 20 и 30 °С. Из этого следует, что Q-температура, при которой А 2 = 0, находится приблизительно при 25 °С. |
|
|
Таблица 1. Вычисления в примере 6.
| с, г/л | p, Па | p / с, Дж/кг | p, Па | p / с, Дж/кг | p, Па | p / с, Дж/кг |
| 20 °С | 30 °С | 40 °С | ||||
| 2.097 | 52.9 | 25.2 | 50.5 | 24.1 | 56.0 | 26.7 |
| 4.194 | 26.7 | 24.0 | 27.6 | |||
| 6.02 | 26.6 | 23.4 | 28.5 | |||
| 10.05 | 26.7 | 22.0 | 30.0 | |||
| 14.89 | 28.0 | 21.2 | 32.8 | |||
| 29.84 | 31.2 | 19.0 | 41.3 |
Ответ: М = 1.01×105 г/моль, Q-температура» 25 °С
Пример 7. (Тема: рассеяние света золями). По результатам измерений мутности как функции концентрации при 23 °С (таблица внизу) определить критическую концентрацию мицеллообразования в водном растворе хлорида додецил триметил аммония С12Н25N(СН3)3Cl (мол. масса 263.88), а так же молярную массу и число агрегации мицелл, при следующих оптических параметрах: длина волны света 436 нм, показатель преломления света в растворителе 1.3328, инкремент показателя преломления D n /D c = 0.156 см3/г.
| с, г/л | 1.83 | 2.25 | 4.27 | 4.78 | 5.45 | 6.20 | 7.09 | 7.93 | 9.55 | 10.92 | 11.97 |
| t ×103, м–1 | 5.47 | 5.62 | 5.66 | 5.71 | 5.71 | 8.81 | 13.09 | 16.66 | 21.75 | 25.09 | 26.89 |
Решение. Критической концентрацией мицеллообразования (ККМ) называют валовую концентрацию амфифильного (или дифильного) ПАВ, ниже которой ПАВ находится в истинном растворе (то есть, в молекулярно-дисперсном состоянии) и выше которой существует равновесие между мицеллами и молекулами ПАВ в растворе.
|
 Если по данным в таблице построить график зависимости t от с ("точки" на рис.1), то можно увидеть, что при с меньше приблизительно 5 г/л мутность почти постоянна, а при с больше приблизительно 6 г/л она быстро растёт с увеличением концентрации. Это свидетельствует о су-ществовании коллоидных частиц в области высоких концентраций. ККМ находится приблизительно при 5.5 г/л. Более точное значение с ККМ можно найти с помощью дополнительных построений. Предположим, что при с < с ККМ зависимость t от с является линейной, и построим соответствующий график (линия 1 на рис.1). Предположим, что в области с > с ККМ, в непосредственной близости к с ККМ, зависимость так же является линейной, и проведём прямую линию через первые две или три точки в этой области (линия 2 на рис. 1). Абсцисса пересечения линий 1 и 2 равна в данном случае 5.70 г/л и является более точной оценкой с ККМ. Значения ККМ обычно выражают в молярной шкале концентраций: С ККМ = 5.70/263.88 = 2.16×10–2 моль/л.
Если по данным в таблице построить график зависимости t от с ("точки" на рис.1), то можно увидеть, что при с меньше приблизительно 5 г/л мутность почти постоянна, а при с больше приблизительно 6 г/л она быстро растёт с увеличением концентрации. Это свидетельствует о су-ществовании коллоидных частиц в области высоких концентраций. ККМ находится приблизительно при 5.5 г/л. Более точное значение с ККМ можно найти с помощью дополнительных построений. Предположим, что при с < с ККМ зависимость t от с является линейной, и построим соответствующий график (линия 1 на рис.1). Предположим, что в области с > с ККМ, в непосредственной близости к с ККМ, зависимость так же является линейной, и проведём прямую линию через первые две или три точки в этой области (линия 2 на рис. 1). Абсцисса пересечения линий 1 и 2 равна в данном случае 5.70 г/л и является более точной оценкой с ККМ. Значения ККМ обычно выражают в молярной шкале концентраций: С ККМ = 5.70/263.88 = 2.16×10–2 моль/л.
Для определения молярной массы мицелл следует использовать уравнение Дебая
 (1)
(1)
где Н – константа, зависящая от оптических свойств раствора (не связанных с мутностью):
 (2)
(2)
А 2, А 3 и т.д. – второй, третий и т.д. вириальные коэффициенты. В области невысоких концентраций раствора, третий и последующие вириальные коэффициенты обычно не проявляются, так что для большинства задач уравнение (1) можно представить в сокращённом виде:
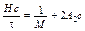 (1а)
(1а)
 Это уравнение является линейным, вида у = а + bx, где х = с, у = Нс /t, а = 1/ М и b = 2 А 2. Поэтому, если построить график в координатах с и Нс /t, то он должен оказаться линейным, со свободным членом а, равным 1/ М.
Это уравнение является линейным, вида у = а + bx, где х = с, у = Нс /t, а = 1/ М и b = 2 А 2. Поэтому, если построить график в координатах с и Нс /t, то он должен оказаться линейным, со свободным членом а, равным 1/ М.
 Однако, необходимо учесть, что в уравнение 1 входит весовая концентрация с коллоидных частиц и мутность t, происходящая от рассеяния света на этих частицах. В случае амфифильных ПАВ, в области с < с ККМ коллоидные частицы отсутствуют, а в области с > с ККМ общая концентрация ПАВ складывается из концентрации ПАВ в составе мицелл (обозначим её с М) и концентрации молекулярно-дисперсного ПАВ, равной с ККМ. Поэтому уравнение (1а) следует переписать:
Однако, необходимо учесть, что в уравнение 1 входит весовая концентрация с коллоидных частиц и мутность t, происходящая от рассеяния света на этих частицах. В случае амфифильных ПАВ, в области с < с ККМ коллоидные частицы отсутствуют, а в области с > с ККМ общая концентрация ПАВ складывается из концентрации ПАВ в составе мицелл (обозначим её с М) и концентрации молекулярно-дисперсного ПАВ, равной с ККМ. Поэтому уравнение (1а) следует переписать:
 (1б)
(1б)
где с М = с - с ККМ, tМ – мутность мицеллярного раствора, уменьшенная на мутность истинного раствора ПАВ с концентрацией с равной с ККМ. В таблице вычислений (справа), в первых двух столбцах переписаны исходные значения с и t, относящиеся к области с > с ККМ. В столбце 3 вычислены значения с М = с – 5.70 [г/л]. Чтобы исправить значения t, следует определить мутность истинного раствора ПАВ (tККМ) при с = с ККМ. Это можно сделать с помощью линейного графика 1 (рис. 1). Из рисунка 1 с достаточно большим размером можно найти, что линия 1 отвечает уравнению t ×103 = 5.43 + 0.0549 с, откуда следует tККМ×103 = 5.43 + 0.0549×5.70 = 5.74 [м–1]. Соответственно, в столбце 4 вычислены значения tМ = t – 5.74×10–3.
|
 =
=  =
=
= 0.657 ×10–3
с единицами измерения:
 =
= 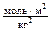
С этим значением Н, в столбце 5 вычислены значения Нс М/tМ и по ним построен график (рис.2), из которого следует 1/ М = 0.101 моль/кг и М = 9.9 кг/моль. Число агрегации мицелл (число молекул ПАВ, входящих в состав одной мицеллы) можно найти как отношение молярной массы мицеллы к молекулярной массе ПАВ, 9.9 ×103/263.88 = 37.5.
Ответ: С ККМ = 2.16 ×10–2 моль/л; М = 9.9 ×103 г/моль; N = 38.
Пример 8. (Тема: электрокинетические явления) Для образца монодисперсного латекса в водном растворе 5.00 смоль/л сульфата натрия обнаружена электрофоретическая подвижность 7.10×10–9 м2×с–1×В–1 при 25.0 °С. Радиус частиц, по результатам рассеяния рентгеновских лучей, составляет 0.117 мкм. Вычислите z-потенциал.
Для оценки свойств растворителя используйте справочные эмпирические уравнения: er = 78.36 – 30 С + 10 С 3/2, и h = 0.894 × (1 + 0.295 C), где С – концентрация Na2SO4 в моль/л, h в сПз.
Решение. Дзета-потенциал сферических частиц может быть вычислен из электрофоретической подвижности по одному из двух теоретических уравнений, справедливость которых зависит от величины радиуса частиц (r) относительно толщины двойного электрического слоя (ù –1). Если радиус много больше толщины ДЭС (то есть, r / ù–1 = r ù >> 1), то уместно уравнение Гельмгольца-Смолуховского u = zere0/h. Если наоборот, радиус много меньше толщины ДЭС (r / ù–1 = r ù << 1), то следует использовать уравнение Хюккеля u = ⅔zere0/h. В промежуточных случаях ни одно из этих уравнений не выполняется в точности, и приходится довольствоваться грубыми оценками z-потенциала по тому или другому уравнению. Поэтому первым шагом в таких задачах является определение соотношения между r и ù –1.
Согласно определению:
ù –1 =  (1)
(1)
где I – ионная сила раствора. Ионную силу вычислим по известному уравнению I = ½S C i z i2, которое для раствора 0.05 моль/л Na2SO4 имеет вид:
 = 0.15 моль/л
= 0.15 моль/л
Относительную диэлектрическую проницаемость растворителя вычислим по эмпирическому уравнению, данному в условии:
er = 78.36 – 30 С + 10 С 3/2 = 78.36 – 30×0.05 +  = 76.97
= 76.97
Помимо известной температуры Т = (25.0 + 273.2) = 298.2 К, остальные величины в (1) являются фундаментальными константами (см. приложение 2): e0 = 8.85×10–12 Ф×м–1; R = 8.31 Дж×моль–1×К–1; F = 9.65×104 Кл×моль–1. Подставим в правую часть (1) соответствующие единицы измерения:
 =
= 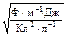 =
=  =
= 
В этих выкладках было принято во внимание, что Ф = Кл2×Дж–1 (приложение 1).
Заметим, что литр равен дециметру кубическому и, следовательно, л–1 = дм–3 = (10–1 м)–3 = 103 м–3. Поэтому, если ионную силу выразить в моль/м3, то ù –1 получится в метрах.
Таким образом, представив ионную силу как I = 0.15×103 моль/м3, вычислим:
ù –1 =  =
= 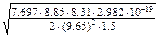 =
=
=  = 7.73×10–10 м
= 7.73×10–10 м
Это эквивалентно 7.73×10–4 мкм. Радиус частиц дан 0.117 мкм, что много больше вычисленной величины 7.73×10–4 мкм (именно, r / ù –1 = 151). Поэтому дзета-потенциал следует вычислять по уравнению Гельмгольца-Смолуховского.
Для вычисления z = u h/ere0 необходимо найти ещё вязкость растворителя по уравнению, данному в условии
h = 0.894(1 + 0.295×0.05) = 0.970 сПз
Поскольку в условии задачи величина u дана в основных единицах СИ, вязкость так же следует выразить в таких единицах, чтобы получить потенциал в вольтах. Как следует из приложения 1, сантипуаз равен миллипаскаль × секунда, то есть 0.970 сПз = 0.970×10–3 Па×с. Таким образом, получается
z = 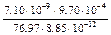 =
=  = 1.01×10–2 В
= 1.01×10–2 В
Ответ: z = 10.1 мВ
Пример 9. (Тема: коагуляция) Быстрая коагуляция 1000 мл золя оксида титана наступает при добавлении к нему 2.06 мл раствора 0.01 моль/л Al2(SO4)3. На основании теории ДЛФО оцените, какой минимальный объём раствора 0.05 моль/л Ca(NO3)2 нужно добавить к тому же объёму этого золя, чтобы вызвать быструю коагуляцию.
Решение. Согласно теории ДЛФО, быстрая коагуляция золя может иметь место, когда высота потенциального барьера на кривой зависимости энергии взаимодействия заряженных поверхностей от расстояния между ними равна нулю или отрицательна. При данной концентрации потенциалопределяющих ионов, высота барьера зависит от концентрации и заряда противоионов. Именно, с увеличением концентрации противоионов высота барьера снижается. Поэтому существует некоторая минимальная (критическая) концентрация электролита, способная вызвать быструю коагуляцию. В теории, эта концентрация даётся громоздким математическим выражением. Существенным в нём является пропорциональность критической концентрации противоионов их заряду в степени –6:
С ККК: z –6 (1)
где тильда (символ:) означает пропорциональность.
С помощью этого соотношения можно предсказать порог коагуляции данного золя одной солью, зная порог коагуляции того же золя другой солью, и использовать эти данные для вычисления, например, объёма раствора соли, достаточного для быстрой коагуляции, как требуется в данной задаче.
Будем обозначать объёмы, концентрации и другие величины с применением нижних индексов: индекс 1 будет относиться к соли Al2(SO4)3, индекс 2 – к Ca(NO3)2, и индекс 0 – к золю TiO2. Из условия задачи можно легко найти порог коагуляции сульфатом алюминия. Он равен концентрации С 01 этой соли в золе, которая получается при добавлении 2.06 мл раствора к 1000 мл золя:
 = 2.06×10–5 моль/л
= 2.06×10–5 моль/л
(это уравнение следует из определения молярной концентрации: число молей C 1 V 1 соли в объёме V 0 + V 1 золя, который получается после добавления раствора соли.)
Для нахождения объёма V 2, который требуется в задаче, можно написать аналогичное уравнение:
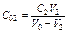
откуда следует:  (2)
(2)
Порог коагуляции С 02 не известен и должен быть найден с помощью теоретического соотношения (1). Для применения (1) нужно знать концентрации противоионов в золе. В растворах, соли диссоциированы на катионы и анионы, и необходимо решить, какие из них являются противоионами в данном золе.
Известно, что потенциалопределяющими ионами для оксидов в водной среде являются ионы Н+ и ОН–. При избытке Н+ оксиды имеют положительный заряд поверхности, а при избытке ОН– – отрицательный. По справочным данным оксид титана имеет точку нулевого заряда (ТНЗ) при рН 4.7. В условии задачи ничего не сказано об исходном составе золя, поэтому остаётся предполагать, что дисперсионной средой является чистая или почти чистая вода (рН около 7). То есть рН > ТНЗ и золь заряжен отрицательно. Поэтому противоионами являются катионы: в случае сульфата алюминия – ионы Al3+ (z 1 = 3), а в случае нитрата кальция – ионы Са2+ (z 2 = 2). При диссоциации, один моль Al2(SO4)3 даёт два моля Al3+, и один моль Ca(NO3)2 даёт один моль Са2+, так что С ККK1 = 2× C 01 и С ККK2 = C 02. Таким образом
С ККК1 = 2 С 01: z 1–6
С ККК2 = С 02: z 2–6
Решая эту пропорцию относительно С02, находим:
 = 4.68×10–4 моль/л
= 4.68×10–4 моль/л
Из (2) теперь следует:  = 9.46 мл
= 9.46 мл
Ответ: 9.46 мл.
Пример 10. (Тема: вязкость растворов полимеров) В следующей таблице приведены значения удельной вязкости hуд как функции концентрации с, измеренные для пяти фракций ацетата целлюлозы, с известными молярными массами М,в ацетоне при 25 °С (в таблице значения М даны в г/моль). Определите с помощью этих данных коэффициенты уравнения Марка-Хаувинка.
| M = | 130×103 | M = | 86×103 | M = | 76×103 | M = | 61×103 | M = | 48×103 |
| с, г/дл | hуд | с, г/дл | hуд | с, г/дл | hуд | с, г/дл | hуд | с, г/дл | hуд |
| 0.094 | 0.289 | 0.114 | 0.286 | 0.118 | 0.247 | 0.138 | 0.239 | 0.152 | 0.209 |
| 0.273 | 0.99 | 0.351 | 1.10 | 0.353 | 0.89 | 0.275 | 0.52 | 0.303 | 0.45 |
| 0.430 | 1.97 | 0.703 | 3.12 | 0.775 | 2.70 | 0.428 | 0.88 | 0.684 | 1.23 |
| 0.546 | 2.77 |
Решение. Вязкость растворов полимеров в низкомолекулярных растворителях при постоянной температуре зависит от концентрации. (Заметим, что концентрацию для такой зависимости часто выражают в граммах на децилитр, г/дл, то есть в граммах на 100 см3 раствора). Наиболее распространённой формой этой зависимости является полиномиальная
Дата добавления: 2015-12-18; просмотров: 23; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
