Опыт № 2 изучение скорости взаимодействия тиосульфата натрия и серной кислоты
Предварительные сведения. Химические реакции идут только в том случае, когда происходит столкновение частиц, обладающих определенной энергией (энергией активации). Чем больше частиц, чем выше их концентрация, тем выше вероятность столкновений между ними, а, следовательно, выше скорость химической реакции.
Порядок выполнения:
1. Используя мерный цилиндр, в четыре пробирки налейте по 1 мл серной кислоты H2SO4. Поставьте их во второй ряд штатива, считая от Вас.
2. В первый ряд, перед пробирками с серной кислотой, поставьте 4 пустые пробирки. В них налейте раствор тиосульфата натрия (Na2S2O3):
в первую - 1 мл раствора тиосульфата натрия (Na2S2O3);
во вторую - 2 мл раствора тиосульфата натрия (Na2S2O3);
в третью - 3 мл раствора тиосульфата натрия (Na2S2O3);
в четвертую - 4 мл раствора тиосульфата натрия (Na2S2O3).
3. Затем в эти же пробирки добавьте дистиллированную воду:
в первую - 3 мл воды;
во вторую - 2 мл воды;
в третью - 1 мл воды;
в четвертую – 0 мл воды.
Проверьте, во всех четырех пробирках должно быть одинаковое количество раствора – 4 мл!!!
4. Приготовьте часы с секундной стрелкой.
5. Добавьте в первую пробирку 1 мл H2SO4 (из второго ряда).
6. Заметьте промежуток времени до появления мути (выделяется коллоидная сера).
7. Повторите аналогичную операцию со следующими тремя парами пробирок. Аналогично измерьте промежуток времени до начала помутнения раствора.
Наблюдения:
Данные эксперимента внесите в таблицу 3, рассчитайте относительную скорость реакции (заполните последнюю колонку) и постройте график, отложив на оси абсцисс концентрацию (0.2; 0.4; 0.6 и 0.8), а на оси ординат – рассчитанную Вами относительную скорость реакции.
|
|
|
Таблица 3

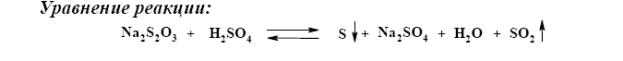
Выводы: Как зависит скорость реакции от концентрации реагентов?
Дата добавления: 2015-12-17; просмотров: 25; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
