Окислительно-восстановительные реакции
5.1.Методом электронного баланса подберите коэффициенты в схеме окислительно - восстановительной реакции
H2S+K2CrO7+H2SO4 =S+Cr2(SO4)3+K2SO4+H2O.
Определите окислитель и восстановитель.
5.2.Методом электронного баланса подберите коэффициенты в схеме окислительно- восстановительной реакции
NaJО3+ NaI + H2SO4 =J2 + Na2SO4 + H2O.
Определите окислитель и восстановитель.
5.3.Подберите коэффициенты в схеме окислительно - восстановительной реакции Na2S2О3+Br2+ NaOH= NaBr +Na2SO4+H2O методом электронного баланса. Определите окислитель и восстановитель.
5.4.Подберите коэффициенты в схеме окислительно- восстановительной реакции HCl+KMnO4= MnCl2+Cl2+KCl+H2O методом электронного баланса. Определите окислитель и восстановитель.
5.5.Составьте электронные уравнения и подберите коэффициенты в схеме окислительно - восстановительной реакции MnO2+HCl=MnCl2+Cl2+H2O. Рассчитайте, сколько граммов окислителя требуется для восстановления 10 граммов соответствующего реакции восстановителя.
5.6.Составьте электронные уравнения и подберите коэффициенты в схеме окислительно - восстановительной реакции Cu+HNO3=Cu(NO3)2+NO+H2O. Рассчитайте сколько граммов окислителя требуется для восстановления 20 граммов, соотвeтствующего реакции восстановителя.
5.7.Составьте электронные уравнения и подберите коэффициенты в схеме окислительно - восстановительной реакции Mg+HNO3=Mg(NO3)2+N2+H2O. Рассчитайте, сколько граммов окислителя требуется для восстановления 20 граммов соотвeтствующего реакции восстановителя
|
|
|
5.8.Составьте электронные уравнения и подберите коэффициенты в схеме окислительно - восстановительной реакции Fe+HNO3 =Fe(NO3)2+NO2+H2O. Рассчитайте, сколько граммов окислителя требуется для восстановления 10 граммов соотвeтствующего реакции восстановителя
5.9.Методом электронного баланса подберите коэффициенты в схеме окислительно- восстановительной реакции
KMnO4+NO+H2SO=4 MnSO4+NO2+K2SO4+H2O. Определите окислитель и восстановитель.
5.10. Методом электронного баланса подберите коэффициенты в схеме окислительно- восстановительной реакции
Cr2O3+KNO3+KOH=K2CrO4+KNO2+H2O. Определите окислитель и восстановитель.
Растворы. Концентрация.
6.1.Раствор объемом 500 мл содержит 5 граммов гидроксида натрия. Определить молярную концентрацию этого раствора.
6.2.Вычислить молярную концентрацию раствора серной кислоты, если массовая доля серной кислоты в этом растворе 12%. Плотность раствора 1,08г/мл при 20оС.
6.3.Вычислить массу хлорида натрия, содержащегося в растворе объёмом 200 мл, если его молярная концентрация равна 2 моль/л.
6.4.Раствор, с массовой долей гидроксида калия 15%, имеет плотность1,14г/мл. Рассчитать молярную концентрацию раствора и молярную долю гидроксида калия.
|
|
|
6.5.Какой объем раствора 1.6 М соляной кислоты необходим для нейтрализации кристаллической соды Na2CO3. 10H2O массой 57,2 граммов.
6.6.Какая масса раствора с массовой долей NаОН 4% потребуется для полной нейтрализации соляной кислоты массой 30 граммов с массовой долей НСl 5%.
6.7.Какая масса цинка может прореагировать с соляной кислотой объемом 50 мл и плотностью 1,1 г/мл, массовая доля соляной кислоты в котором 0,2.
6.8.Раствор хлороводорода объемом 33,2 мл и плотностью 1,1 г/мл прореагировал с аммиаком объемом 4,48 литров, измеренного при н.у. Определить массовую долю хлороводорода в исходном растворе.
6.9.В 100,00 см3 раствора содержится 0,6040 граммов гидроксида натрия. Плотность раствора 1,005 г/см3. Рассчитайте массовую долю и молярную концентрацию эквивалентов гидроксида натрия в растворе.
6.10.В воде массой 128 граммов растворили метиловый спирт объемом 40 мл и плотностью 0,8 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл.
7.Теоретические основы органической химии.
7.1.Предельные углеводороды. Химические свойства на примере метана, способы его получения. Написать изомеры для гексана и назвать по номенклатуре ИЮПАК.
|
|
|
7.2.Непредельные углеводороды на примере алкенов (этилена), их химические свойства и способы получения. Написать изомеры пентена и назвать по по номенклатуре ИЮПАК.
7.3. Непредельные углеводороды на примере алкинов (этилина), их химические свойства и способы получения. Написать изомеры пентина и назвать по по номенклатуре ИЮПАК.
7.4. Ароматические углеводороды на примере бензола, его химические свойства и способы получения. Написать формулы гомологов бензола и назвать их.
7.5.Одноатомные и многоатомные спирты, сходство и отличие в их строении и свойствах. Написать изомеры для бутанола и назвать по по номенклатуре ИЮПАК.
7.6.Алдегиды и кетоны, сходство и отличие в их строении и свойствах. Способы их получения.
7.7.Карбоновые кислоты, их классификация, химические свойства карбоновых кислот на примере уксусной кислоты. Способы получения карбоновых кислот.
7.8.Оксикислоты. Химические свойства и способы их получения.
7.9.Азотсодержащие органические соединения. Аминокислоты, их свойства, получения.
7.10.Дать понятие белкам, жирам, углеводам, их классификациям и биологической роли.
Приложение
Таблица 1.Термодинамические константы некоторых веществ
|
|
|
| Вещество | 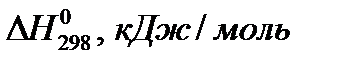
| 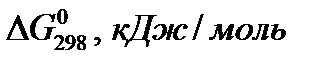
| 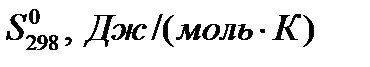
|
| Al (к) | 0 | 0 | 28,31 |
| Al2O3 (к) | – 1675,0 | – 1576,4 | 50,94 |
| BaCO3 (к) | – 1202,0 | – 1138,8 | 112,1 |
| BeCO3 (к) | – 981,57 | – 944,75 | 199,4 |
| C (алмаз) | 1,897 | 2,866 | 2,38 |
| С (графит) | 0 | 0 | 5,74 |
| CO (г) | – 110,5 | – 137,27 | 197,4 |
| CO2(г) | – 393,51 | – 394,38 | 213,6 |
| COCl2(г) | – 223,0 | –210,5 | 289,2 |
| CS2 (г) | – 115,3 | 65,1 | 237,8 |
| CS2 (ж) | – 87,8 | 63,6 | 151,0 |
| C2H2 (г) | 226,75 | 209,2 | 200,8 |
| C2H4 (г) | 52,28 | 68,12 | 219,4 |
| CH4 (г) | – 74,85 | – 50,79 | 186,19 |
| C2H6 (г) | – 84,67 | – 32,89 | 229,5 |
| C6H6 (ж) | 49,04 | 124,50 | 173,2 |
| CH3 OH (ж) | – 238,7 | – 166,31 | 126,7 |
| C2H5 OH (ж) | – 227,6 | – 174,77 | 160,7 |
| Ca (к) | 0 | 0 | 41,62 |
| CaО (к) | – 635,1 | – 604,2 | 39,7 |
| Ca(OH)2 (к) | – 986,2 | – 896,76 | 83,4 |
| CaCО3(к) | – 1206,0 | – 1128,8 | 92,9 |
| Cl2 (г) | 0 | 0 | 223,0 |
| HCl (г) | – 92,30 | – 95,27 | 186,7 |
| HCl (ж) | – 167,5 | – 131,2 | 55,2 |
| Cu (к) | 0 | 0 | 33,3 |
| Cu2O (к) | – 167,36 | – 146,36 | 93,93 |
| CuO (к) | – 165,3 | – 127,19 | 42,64 |
| Cu2S (к) | – 82,01 | – 86,19 | 119,24 |
| Fe (к) | 0 | 0 | 27,15 |
| FeO (к) | – 263,68 | – 244,35 | 58,79 |
| FeCl2(к) | – 341,0 | – 302,08 | 119,66 |
| Fe2O3(к) | – 821,32 | 740,99 | 89,96 |
| Fe3O4(к) | – 1117,1 | – 1015,5 | 146,2 |
| Ge (к) | 0 | 0 | 31,09 |
| GeO (к) | – 305,4 | – 276,1 | 50,2 |
| GeO2 (к) | – 539,74 | – 531,4 | 52,30 |
| H2 (г) | 0 | 0 | 130,6 |
| H2O (г) | – 241,84 | – 228,8 | 188,74 |
| H2O (ж) | 285,84 | – 237,5 | 69,96 |
| N2 (г) | 0 | 0 | 191,5 |
| N2О (г) | 81,55 | 103,6 | 220,0 |
| NО (г) | 90,37 | 86,69 | 210,62 |
| NО2(г) | 33,89 | 51,84 | 240,45 |
| NН3(г) | – 46,19 | – 16,64 | 192,5 |
| NН4Cl (к) | – 315,39 | – 343,64 | 94,56 |
| NН4OH(ж) | – 366,69 | – 263,8 | 179,9 |
| NaOH (к) | – 426,6 | – 377,0 | 64,18 |
| NaCl (к) | – 410,9 | – 384,0 | 72,36 |
| O2 (г) | 0 | 0 | 205,03 |
| Pb (к) | 0 | 0 | 64,9 |
| PbO (к) | – 217,86 | – 188,49 | 67,4 |
| PbO2 (к) | – 276,6 | – 218,99 | 76,44 |
| SO2 (г) | – 296,9 | – 300,37 | 248,1 |
| H2S (г) | – 20,15 | – 33,02 | 205,64 |
| H2S (ж) | – 39,33 | – 27,36 | 122,2 |
| Sn (к) | 0 | 0 | 51,55 |
| SnO (к) | – 286,0 | – 257,32 | 56,74 |
| SnO2 (к) | – 580,8 | – 519,65 | 52,34 |
| Ti (к) | 0 | 0 | 30,6 |
| TiO2 (к) | – 938,6 | – 852,2 | 49,92 |
Основная литература
Ерохин Ю.М. Химия для профессий и специальностей технического и естнственно-научного профилей: учебник для студ. учреждений сред. проф. образования / Ю.М. Ерохимн, И.К, Ковалева. – 2-е изд., стер. – М.:Издательский центр «Академия»,2016. – 448с.
Интернет-ресурсы
www. pvg. mk. ru (олимпиада «Покори Воробьевы горы»).
www. hemi. wallst. ru (Образовательный сайт для школьников «Химия»).
www. alhimikov. net (Образовательный сайт для школьников).
www. chem. msu. su (Электронная библиотека по химии).
www. enauki. Ru (интернет-издание для учителей «Естественные науки»).
www. 1september. ru (методическая газета «Первое сентября»).
www. hvsh. Ru (журнал «Химия в школе»).
www. hij. Ru (журнал «Химия и жизнь»).
www. chemistry-chemists. com (электронный журнал «Химики и химия»).
Дата добавления: 2021-12-10; просмотров: 19; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
