Основные понятия аналитической химии
Аналитическая химия, или аналитика, – это раздел химической науки, разрабатывающий на основе законов химии и физики методы и приемы качественного и количественного анализа атомного, молекулярного и фазового состава вещества. Наряду с данным определением науки используют другое определение, предложенное в 1993 г. на VIII Европейской конференции по аналитической химии: "Аналитическая химия – это научная дисциплина, которая развивает и применяет методы, средства и общую методологию получения информации о составе и природе вещества".
Анализ вещества – это получение опытным путем данных о химическом составе вещества любыми методами: физическими, химическими, физико-химическими. Различают метод и методику анализа. Метод анализа вещества – это краткое определение принципов, положенных в основу анализа. Методика анализа – подробное описание всех условий и операций, которые обеспечивают регламентированные характеристики анализа. Характеристики – это, прежде всего, правильность и воспроизводимость результатов анализа. Правильность анализа отражает близость к нулю систематической погрешности результатов; воспроизводимость показывает степень близости друг к другу результатов отдельных измерений или определений при анализе каждой пробы.
РАСТВОРЫ. ОСНОВНЫЕ ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Растворы - это гомогенные системы переменного состава, состоящие из двух или более компонентов. Любой раствор состоит из растворённого вещества и растворителя.
|
|
|
Растворитель - это компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. Например, в водном растворе глюкозы растворителем является вода, а глюкоза - растворённое вещество.
Способы выражения концентрации растворов:
Концентрация является важной характеристикой раствора: она определяет относительное содержание компонентов в растворе.
Используются различные способы выражения концентрации растворов:
Молярная концентрация - это количество вещества, содержащееся в одном литре раствора (моль/л):
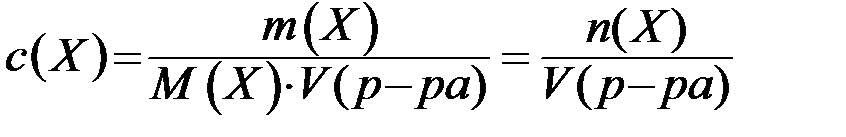 ,
,
где: - количество вещества Х (моль);
V(р-ра) - объём раствора (л).
Молярная концентрация эквивалента(нормальностьраствора) – отношение количества вещества эквивалента к объему раствора. Для расчета молярной массы вещества эквивалента – M(1/Z) (или просто эквивалента, Э) необходимо молярнуюмассу вещества разделить на число эквивалентности, равноесумме зарядов катионов в веществе:
М(в-ва) = M(1/Z),
Σ Z(kat)
где Σ Z(kat) – сумма зарядов катионов в веществе. Для обозначения молярной концентрации эквивалента используют символы:
|
|
|
С(1/Z) или СН, единицы измерения – моль-экв/л.
С(1/Z) = m (в-ва)/M(1/Z) · V(р-ра)
Моляльная концентрация - это количество вещества, содержащееся в одном килограмме растворителя (моль/кг):
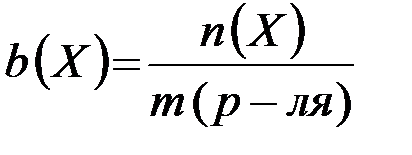 ,
,
где: - количество вещества Х (моль);
m (р-ля) - масса растворителя (кг).
Массовая доля равна отношению массы растворённого вещества к массе раствора (безразмерная величина):
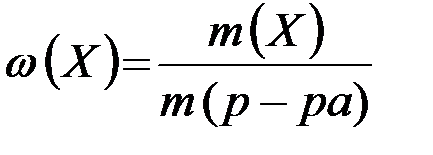 ,
,
где: m (Х) - масса растворенного вещества (г);
m (р-ра) - масса раствора (г).
Молярная доля равна отношению количества растворённого веще-ства к общему количеству веществ в растворе (безразмерная величина):
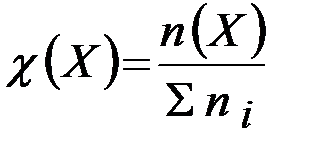 ,
,
где: n (Х) - количество растворенного вещества (моль);
Σni - общее количество вещества всех компонентов раствора.
Ионно-молекулярные (ионные) реакции обмена
Все многообразие химических превращений можно подразделить на реакции, протекающие без изменения степени окисления атомов элементов, входящих в состав реагентов и продуктов, и реакции, сопровождающиеся изменением степени окисления атомов элементов, входящих в состав реагентов и продуктов – окислительно-восстановительные реакции.
|
|
|
Реакции без изменения степени окисления атомов элементов наиболее часто протекают с участием ионов в растворах, поскольку исходными реагентами таких реакций являются электролиты.
Обменные ионно-молекулярные реакции с участием электролитов представляют собой процессы замещения одного иона другим одноименным ионом (катионом или анионом) в молекуле электролита. В этих реакциях ионы обладают существенно более высокой реакционной способностью по сравнению с молекулами, и поэтому скорость прямой и обратной реакций зависит от концентрации ионов, фигурирующих в левой и правой частях уравнения. Из сказанного следует, что основным фактором, влияющим на смещение равновесия в реакциях растворов электролитов, является изменение концентрации ионов, и обменные реакции преимущественно протекают в направлении образования из ионов молекулярных соединений: осадков, газов или слабых электролитов, что полностью соответствует принципу Ле-Шателье. Если ионы, фигурирующие в правой части уравнений реакций, объединяются между собой в молекулярные формы, их концентрация резко падает, что обеспечивает смещение равновесия в сторону образования таких ионов.
Ионно-молекулярные или ионные уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты полностью диссоциированы и поэтому записываются в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записываются в молекулярной форме.
|
|
|
Растворимость электролитов в насыщенном растворе определяется произведением растворимости ПР, представляющим собой произведе-ние концентраций ионов (катиона и аниона), находящихся в равновесии с осадком вещества, образуемого этими ионами в степенях, равных стехио-метрическим коэффициентам при этих ионах. Так, для осадка 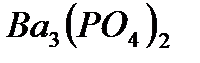 , находящегося в равновесии с ионами
, находящегося в равновесии с ионами 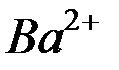 и
и 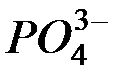 в растворе
в растворе
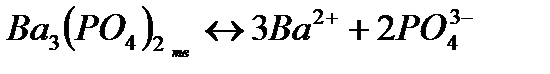
произведение растворимости выражается равенством:
ПР = 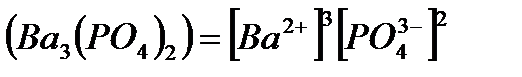
Зная значение ПР, можно решать вопросы, связанные с образованием или растворением осадков в химических реакциях.
Важным количественным показателем, используемым при анализе ионных реакций, является водородный показатель рН, характеризующий концентрацию ионов водорода в водных растворах
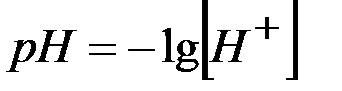 (1)
(1)
При этом концентрация ионов водорода связана с ионным произведением воды Кw , вытекающим из ее обратимой диссоциации
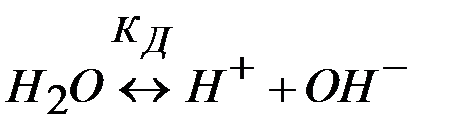 (2)
(2)
Константа диссоциации в соответствии с уравнением (2) определяется как
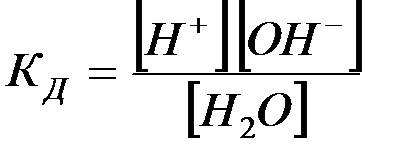 (3)
(3)
Поскольку концентрации [H+] и [OH–]пренебрежимо малы по срав-нению с концентрацией воды, последнюю можно считать постоянной. То-гда уравнение (3) можно записать в виде
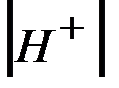
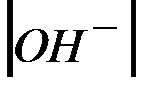 =
= 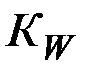 (4)
(4)
где 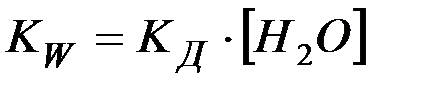
Как всякая константа, КW не зависит от концентрации Н+ и ОН– в растворе. Так, если в воду добавить протонную кислоту, то концентрация ионов Н+ резко возрастет. Тогда равновесие (2) заметно сместится в левую сторону, что приведет к значительному снижению концентрации ионов ОН–, но ионное произведение воды останется неизменным. Таким обра-зом, в водных растворах концентрации Н+ и ОН– в условиях постоянства температуры взаимно связаны между собой: зная концентрацию одного из них, можно определить концентрацию другого, пользуясь выражением (4).
При обычной температуре 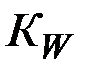 =10–14. Поэтому в нейтральном рас-творе
=10–14. Поэтому в нейтральном рас-творе 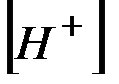
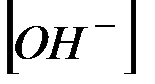 = = 0,5=10–7 моль/л и рН в соответствии с выражени-ем (1) равен 7.
= = 0,5=10–7 моль/л и рН в соответствии с выражени-ем (1) равен 7.
В кислой среде 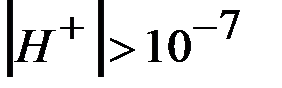 и
и 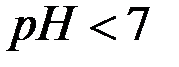 .
.
В щелочной среде 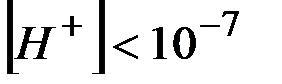 и
и 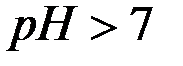 .
.
Реакцию среды на практике можно определить при помощи кислотно-основных индикаторов, которые меняют свой цвет в зависимости от рН раствора. К наиболее распространенным относятся лакмус, фенолфталеин и метилоранж.
Окраска индикаторов в различных средах
| Индикатор | Цвет индикатора в средах | ||
| в кислой | в нейтральной | в щелочной | |
| Метилоранж | красный | оранжевый | желтый |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Лакмус | красный | фиолетовый | синий |
По аналогии с рН введен показатель рОН:
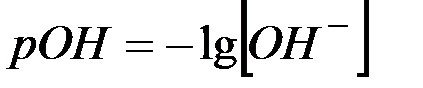 (5)
(5)
и показатель 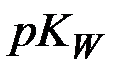 , равный
, равный 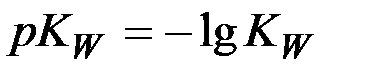 . Тогда, логарифмируя урав-нение (4), имеем:
. Тогда, логарифмируя урав-нение (4), имеем:
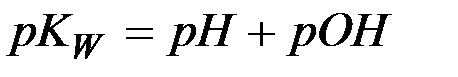 (6)
(6)
Так как 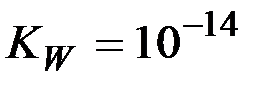 , то
, то 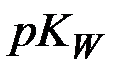 =14, и равенство (6) приводится к виду:
=14, и равенство (6) приводится к виду:
.  (7)
(7)
Уравнения (6) и (7) показывают, что зная рН, можно рассчитать рОН, и наоборот, по известному значению рОН легко определяется рН.
Частным случаем ионных реакций является гидролиз солей – обменное взаимодействие соли с водой, приводящее к образованию слабого электролита. Показателем глубины протекания этой реакции является степень гидролиза, определяемая как отношение концентрации гидроли-зованных молекул “с” к исходной концентрации растворенных молекул “сO”:
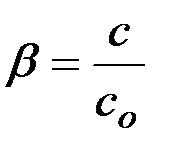 (8)
(8)
Гидролиз является реакцией, обратной нейтрализации, поэтому его результатом является образование пары кислота – основание.
Если объектом гидролиза являются соли сильного основания и сильной кислоты, то такие соли не гидролизуются, так как обратная гидролизу реакция необратима.
Гидролиз соли, образованной слабой кислотой и сильным основанием.
Рассмотрим пример гидролиза ацетата натрия:
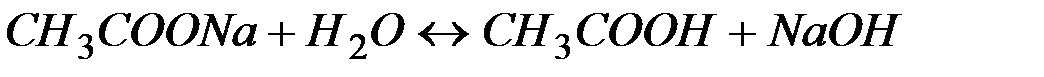 (9)
(9)
В ионной форме уравнение (9) примет вид:
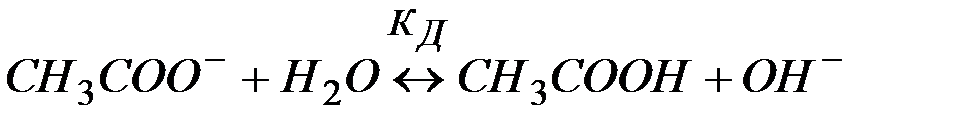 (10)
(10)
Поскольку результатом гидролиза является образование малодиссо-циированного соединения СН3СООН, реакция, выраженная уравнением (9), принимает обратимый характер. Можно видеть, что результатом гидролиза является образование некоторого избыточного количества гидроксид–ионов. Таким образом, при гидролизе соли, образованной сильным основанием и слабой кислотой, среда становится щелочной ( 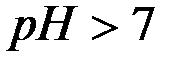 ).
).
В общем виде реакция гидролиза соли сильного основания и слабой кислоты по аналогии с (10) запишется
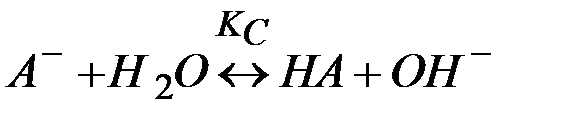 (11)
(11)
Если гидролизу подвергается многоосновный анион, то гидролиз протекает по стадиям:
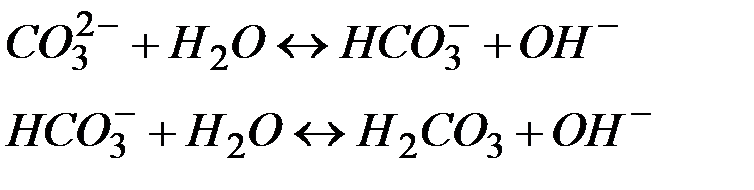
Константа гидролиза по первой ступени (КГ.1 = 2 . 10–4) значительно выше, чем по второй (КГ.2 = 2,2 . 10–8 ). Поэтому, при расчете концентраций ионов [Н+] или [ОН–] второй (или третьей) ступенью гидролиза пренебрегают.
Гидролиз соли, образованной сильной кислотой и слабым основанием.
Рассмотрим пример гидролиза хлорида аммония:
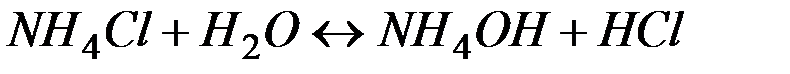
или в ионной форме

Можно видеть, что результатом гидролиза является образование из-быточного количества ионов водорода. Таким образом, гидролиз соли, образованной сильной кислотой и слабым основание, приводит к формированию кислой среды.
Гидролиз соли, образованной слабой кислотой и слабым основанием.
Рассмотрим пример гидролиза подобной соли:
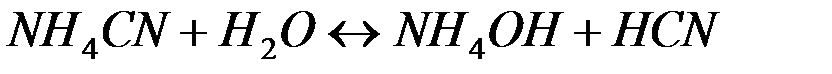
В общем виде эта реакция может быть представлена уравнением:
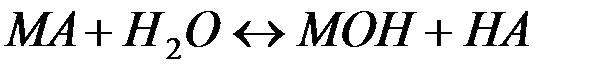 (23)
(23)
Отдельно гидролиз по катиону и по аниону следует уравнениям:
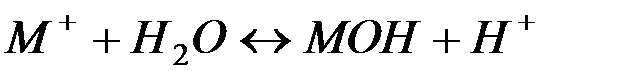
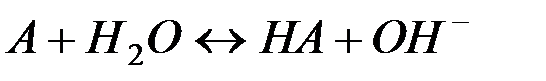
Можно видеть, что в результате гидролиза образуются и катионы водорода, и анионы гидроксида. Нетрудно показать, что константа гидролиза является функцией констант диссоциации продуктов гидролиза – слабого основания (МОН) и слабой кислоты (НА):
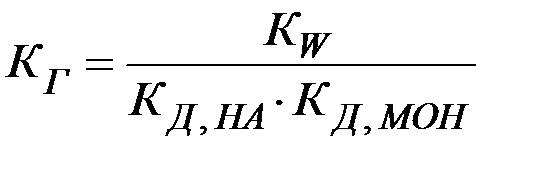
(24)
Степень гидролиза и концентрация в этом случае не зависят от исходной концентрации соли:
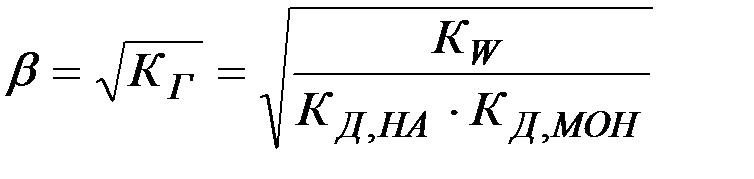 (25)
(25)
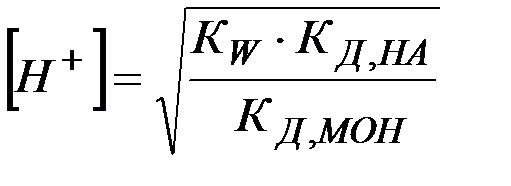 (26)
(26)
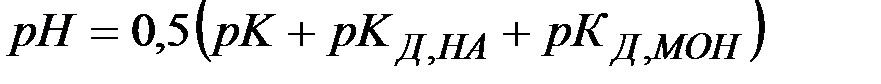 (27)
(27)
Из выражений (26), (27) видно, что в зависимости от соотношения между кислотностью и основностью продуктов гидролиза среда может приобретать либо кислую, либо щелочную реакцию.
Ионно-молекулярные реакции обмена имеют важное значение в ана-литической химии, в препаративном неорганическом анализе, а также при получении ряда ценных неорганических соединений.водах солей кальция, магния и железа.
Дата добавления: 2021-12-10; просмотров: 21; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
