Примеры решения типовых задач.
Пример 1.Составление уравнений окислительно-восстановительных реакций методом электронного баланса.
Задача. Составьте уравнение окислительно-восстановительной реакции окисления дисульфида серы ( II ) кислородом.
Решение. Продуктами этой реакции являются SO 2 и Fe 2 O 3.Соответственно степень окисления железа изменяется от +2 до +3, степень окисления серы – от –1 до +4, степень окисления кислорода – от 0 до –2. Можно видеть, что функцию восстановителя в этой реакции выполняют совместно Fe 2+ и S 2 2-, функцию окислителя – О2. В этой связи представим реакции окисления и восстановления схемой:
| 11 | О2+ 4е  2 О2- 2 О2-
| восстановление, окислитель О2 |
| 4 | Fe2+ – 1 е  Fe3+
S22- – 10е Fe3+
S22- – 10е  2 S4+ 2 S4+
| окисление, восстановитель FeS 2 |
4 FeS2 + 11 О 2  2 Fe2O3 + 8 SO2
2 Fe2O3 + 8 SO2
По числу принятых кислородом и отданных FeS 2 электронов определяем коэффициенты перед окислителем и восстановителем. С учетом поэлементного баланса находим коэффициенты перед формулами продуктов реакции.
Пример 2.Составление уравнений окислительно-восстановительных реакций методом электронно-ионного баланса.
Задача. Составьте уравнение окислительно-восстановительной реакции между перманганатом калия и сульфитом натрия в среде серной кислоты.
Решение. KMnO 4иNa 2 SO 3– сильные электролиты, поэтому в растворе они практически полностью диссоциируют на ионы. Окисляющим началом является анион MnO 4 –, в котором марганец находится в степени окисления +7. В то же время у серы в сульфит-анионе имеется ресурс окисления до сульфат-аниона, поэтому он является восстановителем. Известно, что в кислой среде перманганат-анион восстанавливается до Mn 2+ . Поэтому уравнения полуреакций записываются в виде:
|
|
|
| 2 | MnO 4– + 8Н+ + 5е  Mn 2+ + 4 Н2О Mn 2+ + 4 Н2О
| восстановление, окислитель KMnO 4 |
| 5 | S О32– + Н2О – 2е  S О42– + 2Н+ S О42– + 2Н+
| окисление, восстановитель Na 2 SO 3 |
2 MnO 4 – + 16Н+ + 5 S О32– +5Н2О  2 Mn 2+ + 8 Н2О + 5 S О42– + 10Н+
2 Mn 2+ + 8 Н2О + 5 S О42– + 10Н+
Можно видеть, как пара Н+ – Н2О осуществляет перераспределение кислорода между реагентами и продуктами реакции.
Коэффициенты перед строками уравнений полуреакций отражают требования электронного баланса: количество электронов, принятых окислителем должно быть равно количеству электронов, отданных восстановителем. Суммирование левых и правых частей уравнений реакций с учетом умножения их на указанные коэффициенты дает уравнение окислительно-восстановительной реакции в ионно-молекулярной форме, приведенное под чертой. Сокращение подобных членов в этом уравнении приводит к более компактной его форме

Переход к молекулярной форме приводит к окончательному виду уравнения:  .
.
Пример 3.Составление уравнений окислительно-восстановительных реакций, протекающих в нейтральной среде.
|
|
|
Задача. Составьте уравнение окислительно-восстановительной реакции между сульфатом марганца( II ) и перманганатом калия.
Решение. Продуктом этой реакции является MnO 2 , следовательно, в роли окислителя выступает анион  , а восстановителя –
, а восстановителя –  . Составляем уравнение полуреакции, учитывая, что в левой части этих уравнений в качестве перераспределителя кислорода выступает вода.
. Составляем уравнение полуреакции, учитывая, что в левой части этих уравнений в качестве перераспределителя кислорода выступает вода.
| 2 | MnO 4– + 2Н2О+ 3е  Mn О2 + 4ОН – Mn О2 + 4ОН –
| восстановление, окислитель MnO 4 – |
| 3 | Mn 2+ + 2Н2О – 2е  Mn О2+ 4Н+ Mn О2+ 4Н+
| окисление, восстановитель Mn 2+ |
2 MnO 4 – + 10Н2О+ 3 Mn 2+  5 Mn О2 + 8ОН –+ 12Н+.
5 Mn О2 + 8ОН –+ 12Н+.
Суммирование левых и правых частей уравнений полуреакций с учетом умножения их строк на приведенные коэффициенты дает ионно-молекулярное уравнение, представленное под чертой. С учетом того, что рекомбинация 8Н + и 8ОН – в правой части этого уравнения дает 8 молекул воды, сокращаем воду в левой и правой частях и получаем уравнение
2 MnO 4 – + 2Н2О+ 3 Mn 2+  5 Mn О2 + 4Н+.
5 Mn О2 + 4Н+.
Переход к молекулярной форме приводит к окончательному виду уравнения:
 .
.
Пример 4.Составление уравнений окислительно-восстановительных реакций с участием органических соединений.
|
|
|
Задача. Составьте уравнение реакции окисления этилбензола перманганатом калия в нейтральной среде.
Решение. Роль окислителя в этой реакции выполняет перманганат-анион, а восстановителя – этилбензол,  . В нейтральной среде перманганат-анион переходит в
. В нейтральной среде перманганат-анион переходит в 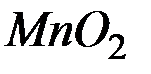 , а этилбензол деструктивно окисляется до бензойной кислоты и углекислого газа. В этой связи уравнение полуреакций записывается в виде
, а этилбензол деструктивно окисляется до бензойной кислоты и углекислого газа. В этой связи уравнение полуреакций записывается в виде
| 4 | MnO 4– + 2Н2О+ 3е  Mn О2 + 4ОН – Mn О2 + 4ОН –
| восстановление, окислитель MnO 4 – |
| 1 |  + 4Н2О – 12е + 4Н2О – 12е   + +  + 12Н+ + 12Н+
| окисление, восстановитель 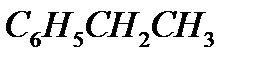
|
4 MnO 4 – + 12Н2О+ 
 4 Mn О2 +
4 Mn О2 +  +
+  + + 12 Н2О+ 4ОН –
+ + 12 Н2О+ 4ОН –
Сокращая воду в левой и правой частях полученного уравнения и учитывая взаимодействия
 + ОН –
+ ОН –  + Н2О
+ Н2О
 + 2ОН –
+ 2ОН – 
 + Н2О,
+ Н2О,
приходим к уравнению
4 MnO 4 – + 
 4 Mn О2 +++2Н2О+ ОН-
4 Mn О2 +++2Н2О+ ОН-
Переходим к молекулярной форме уравнения:
4КМ nO 4 + 
 4 Mn О2 +++2Н2О+ + КОН.
4 Mn О2 +++2Н2О+ + КОН.
Пример 5.Определение окислительно-восстановительных молярных масс эквивалентов.
Задача. Чему равен эквивалент окислителя в реакции ?
Решение . Молярная масса эквивалента окислителя (восстановителя) равна его молярной массе, деленной на число принятых (или отданных) электронов. В приведенной реакции окислителем является (М r =158, М=158г/моль), а процесс восстановления идет по схеме .
|
|
|
Следовательно, молярная масса эквивалента окислителя равна
(г/моль).
Пример 6 . Определение возможности протекания окислительно-восстановительной реакции по величине изменения энергии Гиббса (изобарно-изотермического потенциала).
Задача . Определите возможность протекания окислительно-восстановительной реакции
 ,
,
если стандартные значения энергии Гиббса равны:
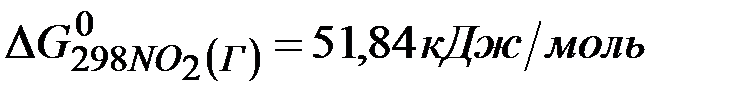 ;
;  ;
;
 ;
; 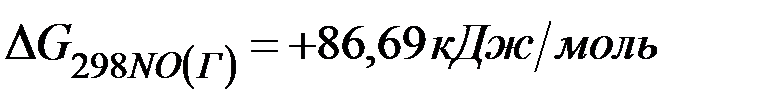 .
.
Решение. Определяем 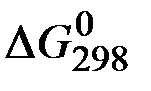 процесса
процесса
 ;
;
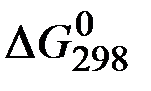 =
=  +
+ 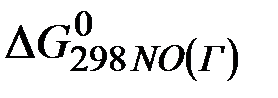 – 3
– 3  –
–  =
=
=2(-79,91) + 86,69 – 3(51,84) – (-237,5)=8,65кДж .
Так как  > 0, то протекание данной реакции возможно только в обратном направлении, т.е. справа налево.
> 0, то протекание данной реакции возможно только в обратном направлении, т.е. справа налево.
КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ МЕТОДЫ АНАЛИЗА
Анализ вещества может проводиться с целью установления качественного или количественного его состава. В соответствии с этим различают качественный и количественный анализ.
Качественный химический анализ – это определение (открытие) химических элементов, атомов, ионов, атомных групп, молекул в анализируемом веществе. Качественный химический анализ включает в себя дробный и систематический виды анализа. Дробный анализ – обнаружение иона или вещества в анализируемой пробе с помощью специфического реагента в присутствии всех остальных компонентов пробы. Систематический анализ предусматривает разделение анализируемых ионов по аналитическим группам с последующим обнаружением каждого иона в своей группе.
Количественный химический анализ – это определение количественного состава вещества, т.е. установление количества химических элементов, ионов, атомов, атомных групп, молекул в веществе. В качественном анализе используют термин "открытие", в количественном – "определение".
Физико-химические методы анализа (инструментальные методы) – это методы, основанные на использовании зависимости между измеряемыми физическими свойствами вещества и его качественным и количественным составом. Эти методы основаны на применении физико-химических приборов.
Элементный анализ – это качественный и количественный химический анализ, в результате которого определяют, какие химические элементы и в каком количестве входят в состав вещества.
Качественный анализ позволяет установить, из каких химических элементов состоит анализируемое вещество и какие ионы, группы атомов или молекулы входят в его состав. При исследовании состава неизвестного вещества качественный анализ всегда предшествует количественному, так как выбор метода количественного определения составных частей анализируемого вещества зависит от данных, полученных при его качественном анализе.
Качественный химический анализ большей частью основывается на превращении анализируемого вещества в какое-нибудь новое соединение» обладающее характерными свойствами: цветом, определенным физическим состоянием, кристаллической или аморфной структурой, специфическим запахом и т. п. Химическое превращение, происходящее при этом, называют качественной аналитической реакцией, а вещества, вызывающие это превращение, называют реактивами (реагентами). Аналитический признак – такое свойство анализируемого вещества или продуктов его превращения, которое позволяет судить о наличии в нем тех или иных компонентов. Характерные
аналитические признаки: цвет, запах, угол вращения плоскости поляризации света, радиоактивность, способность к взаимодействию с электромагнитным излучением.
Аналитическая реакция – химическое превращение исследуемого вещества при действии аналитического реагента с образованием продуктов с заметными аналитическими признаками. В качестве аналитических реакций чаще всего используют следующие реакции: образование окрашенных соединений, выпадение или растворение осадков, выделение газообразных веществ, образование кристаллов характерной формы, окрашивание пламени, образование соединений, люминесцирующих в растворах.
Рассмотрим несколько примеров.
1. Образование окрашенных соединений. Катионы медиCu2+ в водных растворах при взаимодействии с аммиаком образуют растворимый комплекс [Cu(NH3)4]2+ яркого сине-голубого цвета. С помощью реакции солей меди (II) с раствором аммиака»можно определить катионы Cu2+. Катионы Fe3+ при введении в раствор тиоцианат-ионов (роданид-ионов) NCS− окрашиваются вкрасный цвет вследствие образования комплекса [Fe(NCS)6]3−красного цвета.
2. Выпадение или растворение осадков. Катионы барияBa2+, присутствующие в водном растворе, можно осадить придействии сульфат-ионов: Ba2+ + SO2-4 → BaSO4↓.
Образуется белый малорастворимый осадок сульфата бария. Катионы кальция Ca2+ можно осадить из раствора при действии карбонат-иона:
Ca2+ + СО2-3 → СаСО3↓.
Белый осадок карбоната кальция растворяется при действии сильных кислот:
СаСО3↓ + 2 HCl → CaCl2 + CO2↑ + H2O.
3.Реакции с выделением газообразных веществ. При добавлении к раствору соли аммония щелочи выделяется газообразный аммиак:
NH4+ + OH- → NH3 · H2O ⎯⎯→ NH3↑ + H2O.
Определить выделяющийся аммиак можно по запаху или поизменению цвета влажной лакмусовой бумаги.
При действии на сульфиды щелочных металлов сильных кислот выделяется сероводород:
S2-+ 2 H+ → H2S↑.
При анализе смеси нескольких веществ, близких по химическим свойствам, их предварительно разделяют и только затем проводят характерные реакции на отдельные вещества (или ионы), поэтому качественный анализ охватывает не только отдельные реакции обнаружения ионов, но и методы их разделения.
Количественный анализ позволяет установить количественные соотношения составных частей данного соединения или смеси веществ. В отличие от качественного анализа количественный анализ дает возможность определить содержание отдельных компонентов анализируемого вещества или общее содержание определяемого вещества в исследуемом продукте. Методы количественного анализа подразделяются на химические (гравиметрический, титриметрический); физические (спектральный анализ, люминесцентный, ренгеноструктурный и т.д.) и физико-химические методы анализа (кондуктометрия, колориметрия).
Методы качественного и количественного анализа, позволяющие определять в анализируемом веществе содержание отдельных элементов, называют элементным анализом; функциональных групп — функциональным анализом; индивидуальных химических соединений, характеризующихся определенным молекулярным весом, — молекулярным анализом.
Качественный анализ катионов и анионов. В общем случае, когда исследуют неорганическое вещество, сначала проводят его качественный анализ, затем количественный. Полезную информацию о качественном составе дают предварительные испытания: окрашивание пламени; прокаливание в фарфоровой чашке; получение окрашенных перлов; обнаружение окислителей; восстановителей; газообразующих ионов и др. После предварительных испытаний анализируемое вещество переводят в раствор, который подвергают систематическому анализу на катионы и анионы.
Когда обнаружены катионы и анионы, входящие в состав вещества, делают заключение о его молекулярном составе, т.е. представляет ли оно собой основание, кислоту, соль, смесь солей и т д. При этом объединяют всю информацию, полученную из определения физических свойств, предварительных испытаний и результатов химического анализа.
Анализ смесей катионов. В химическом анализе неорганических веществ имеют дело преимущественно с водными растворами электролитов, те соединений, диссоциирующих в растворах с образованием ионов. При этом все катионы делят на группы по характерному действию на них групповых реагентов.
В настоящее время разработано и используются три основные схемы деления неорганических катионов на группы сероводородная (используется редко из-за ядовитости сероводорода), кислотно-основная(самая распространенная) и аммиачно-фосфатная. В сероводородной схеме за основу принята растворимость сульфидов катионов в различных средах; в кислотно-основной - растворимость гидроксидов; в аммиачно-фосфатной - растворимость фосфатов. В данном пособии предпочтение отдано кислотно-основному методу делению катионов на аналитические группы (таблица 1).
| Группа | Катионы | Групповой реагент | Растворимость Соединений |
| I | Ag+,Pb2+, Hg2+ | 2M HCl | Хлориды не растворимы в воде. |
| II | Ca2+, Sr2+, Ba2+ | 1M H2SO4 | Сульфаты не растворимы в воде. |
| III | Zn2+, Sn(IV), Al3+, Cr3+, Sn2+, As (III) | 4M NaOH (изб.) | Гидроксиды амфотерны, растворяются в избытке щелочи. |
| IV | Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb3+ | 25%-ныйNH3 | Гидроксиды нерастворимы в избытке щелочи |
| V | Co2+, Ni2+, Cu2+, Cd2+, Hg2+ | 25%-ный NH3 (изб.) | Гидроксиды растворяются в избытке аммиака с образованием комплексных соединений |
| VI | Na+, K+, NH4+ | нет | Хлориды, сульфаты, гидроксиды растворимы в воде |
Анализ смесей анионов
Классификация катионов по кислотно-основной схеме
Все анионы являются составной частью кислот и соответствующих солей. Состояние анионов в растворе зависит от среды раствора. Некоторые анионы разлагаются при действии концентрированных кислот с выделением соответствующих газов. Большинство элементов, образующих анионы, обладают переменной валентностью и при действии окислителей или восстановителей изменяют степень окисления. При этом меняется и состав аниона.
Групповые реакции анионов
Реагенты по своему действию на анионы разделяют на следующие группы:
- Реактивы, разлагающие вещества с выделением газов. К ним относятся разбавленные минеральные кислоты – соляная или серная.
- Реактивы, выделяющие анионы из растворов в виде малорастворимых осадков:
а) BaCl2 в нейтральной. Осаждаются SO2-4, SO32-, S2O32-, CO32-, PO43-,
B4O72-, AsO42-, SiO32-;
б) ANO3 в 2н HNO3. Осаждаются: Cl- ,Br-, I-, S2-.
3) Реактивы - восстановители (KI)
4) Реактивы- окислители (KMnO4, I2, HNO3(конц) ,H2SO4).
Анионы при анализе в основном не мешают обнаружению друг друга, поэтому групповые реакции применяют не для разделения, а для предварительной проверки наличия или отсутствия той или иной группы анионов.
Выполнение качественных реакций.
В качественном полумикроанализе применяют следующие операции: нагревание раствора, осаждение, отделение осадка от раствора, промывание осадка, выпаривание растворов и прокаливание сухого остатка.
Нагревание раствора ведут в пробирке на водяной бане. Кипячение раствора можно осуществлять в химическом стакане или фарфоровом тигле
Аналитические реакции, связанные с осаждением и растворением осадков, проводят в пробирках при перемешивании стеклянной палочкой после добавления каждой порции реактива. Все реакции выполняют по указанной методике, соблюдая порядок приливания реактивов, температуру, проверяя полноту осаждения и др.
Отделение осадка от раствора производят центрифугированием. Конические пробирки с разделяемой смесью ставят в гнездо центрифуги. В противоположный патрон помещают для равновесия такие же пробирки с равным объемом воды. Центробежная сила отбрасывает частицы осадка в конец пробирки и уплотняет его. Раствор, освобожденный от частиц осадка, называют центрифугатом. Его переносят в другую пробирку пипеткой с резиновым колпачком, стараясь не задеть осадок. Оставшуюся над осадком жидкость удаляют капиллярной пипеткой (без колпачка).
Осадок, отделенный от центрифугата, нужно обязательно промыть для удаления посторонних ионов дистиллированной водой, иногда разбавленным раствором осадителя. Для этого прибавляют 1-2 мл промывной жидкости, тщательно перемешивают стеклянной палочкой полученную смесь и вновь центрифугируют. Центрифугат удаляют пипеткой.
Концентрирование растворов или полное удаление воды проводят в фарфоровых чашках, нагреваемых на водяной бане. Выпаривают осторожно, не допуская разбрызгивания выделяющихся кристаллов водяным паром.
Прокаливание смесей для удаления солей аммония или органических веществ проводят в тиглях или фарфоровых чашках нагреванием на песчаных банях или электроплитке и только после остывания переносят на рабочий стол. Горячие тигли переносят щипцами.
Вопросы для самостоятельной работы по разделу Аналитическая химия:
1. Буферные растворы
2. Окислительно-восстановительные потенциалы
3. Константы кислотности и основности
4. Типы комплексных соединений. Устойчивость комплексных соединений
5. Аналитические реактивы. Техника выполнения анализа
6. Анализ смеси катионов I, II, III аналитических групп.
7. Анализ смеси катионов IV, V, VI аналитических групп
8. Титры, их приготовление и стандартизация
9. Перманганатометрия. Йодометрия. Хроматография.
10. Физико-химические методы анализа.
КОНТРОЛЬНАЯ РАБОТА
Дата добавления: 2021-12-10; просмотров: 24; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
