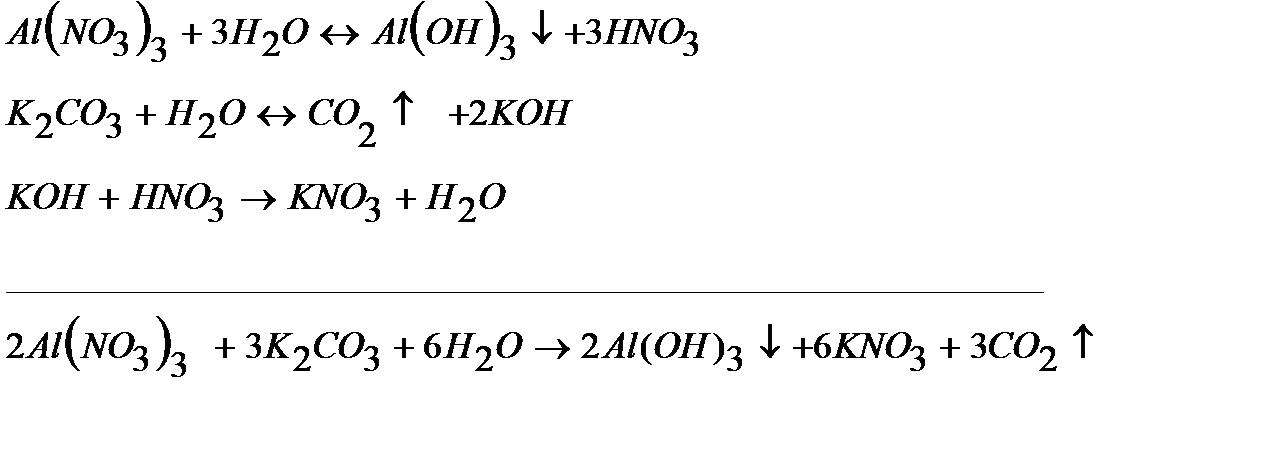Примеры решения типовых задач.
Пример 1. Расчет массовой доли, молярной концентрации и молярной концентрации эквивалента раствора.
Задача. Определите массовую долю, молярную концентрацию и молярную концентрацию эквивалента раствора, полученного при смешении 200 мл 2М раствора серной кислоты ( ρ=1,18 г/мл) и 200 мл 8% раствора серной кислоты ( =1,05 г/мл).
Решение. Рассчитаем массу первого раствора и массу серной кислоты в нем:
m(р-ра)1= ρ(р-ра)1 .V(р-ра)1=1,18 ·200=236 (г);
m(H2SO4)1 = n(H2SO4) · M(H2SO4)=c(H2SO4) ·V(р-ра)1·М(H2SO4)=
=2·0,2·98=39,2(г);
Масса второго раствора и масса серной кислоты в нем равны
m(р-ра)2 = ρ(р-ра)2·V(р-ра)2 = 1,05 · 200=210 (г);
m(H2SO4)2 = m(р-ра)2 · ω(H2SO4)=210 .0,08 =16,8 (г).
Массовую долю полученного раствора рассчитываем по формуле:
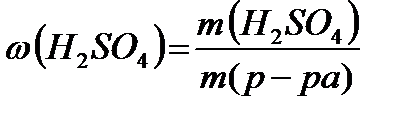 =
= 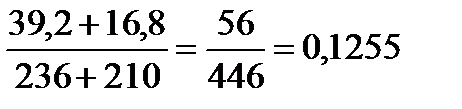 (12,6%)
(12,6%)
Молярная концентрация раствора
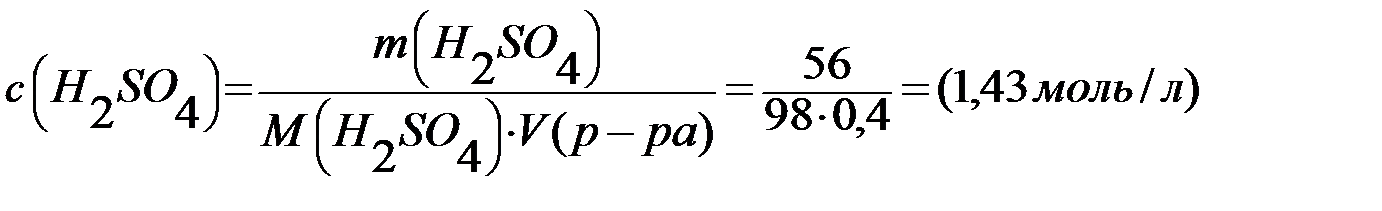 ;
;
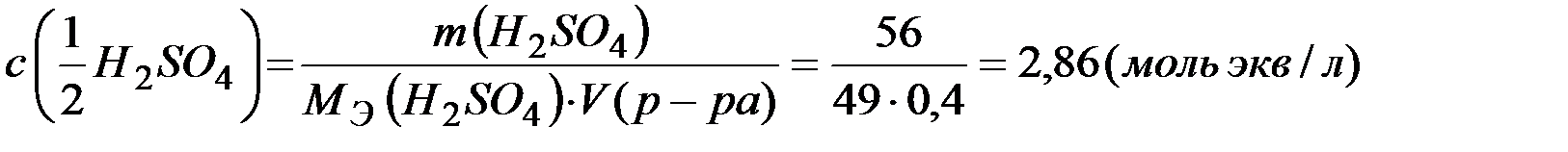
Пример 2. Растворение веществ, взаимодействующих с водой, и нахождение концентрации полученного раствора.
Задача. Найдите массовую долю вещества в растворе, полученном при взаимодействии 4,6 г металлического натрия с 75,6 мл воды.
Решение. Запишем уравнение реакции взаимодействия натрия с водой:
0,2моль 0,2моль 0,1моль
2Na + 2H2O = 2NaOH + H2
2моль 2моль 1моль
Рассчитаем количество вещества и массу NaOH:
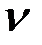 (NaOH)=
(NaOH)= 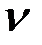 (Na) =
(Na) = 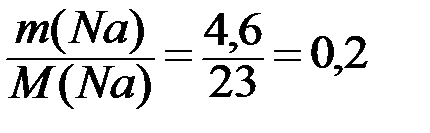 (моль);
(моль);
m (NaOH) = М(NaOH) . (NaOH)=40 .0,2=8(г).
Масса полученного раствора и массовая доля гидроксида натрия равны:
m(р-ра)= m(H2O) + m(Na) – m(H2) =76,5 + 4,6 - 2 .0,1=80 (г)
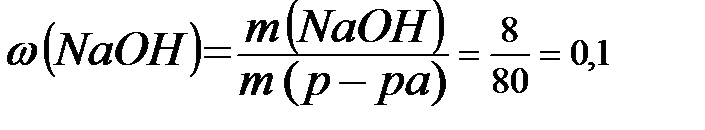 (10%).
(10%).
Пример 3. Составление ионно-молекулярных уравнений на основе данных о реагентах и продуктах реакции.
|
|
|
Задача. Напишите ионно-молекулярные уравнения реакций взаимодействия между водными растворами:
а) 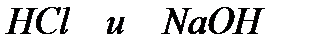
б) 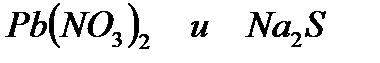
в) 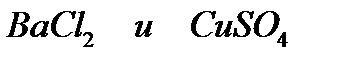
г) 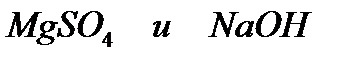
д) 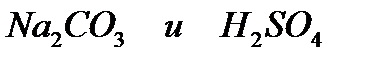
Решение. Запишем уравнения взаимодействия указанных соединений в молекулярной форме:
а) 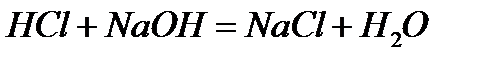
б) 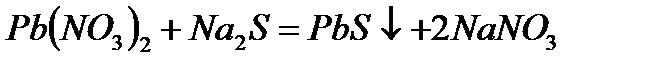
в) 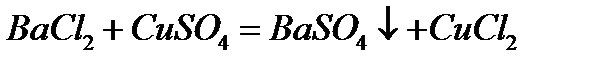
г) 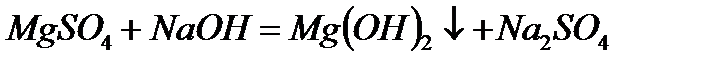
д) 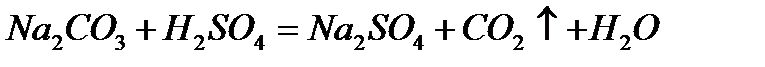
Из рассмотренных примеров видно, что в каждой из реакций присутствует предпосылка для количественного связывания реагентов – образование осадков (PbS, BaSO4, Mg(OH)2), газов (CO2) или недиссоциированных соединений (H2O).
Запишем каждую из этих реакций в ионно–молекулярной форме:
а) 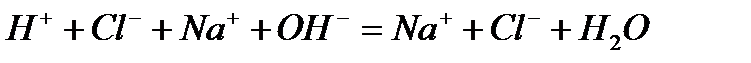
б) 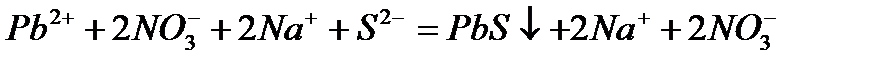
в) 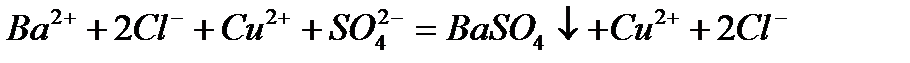
г) 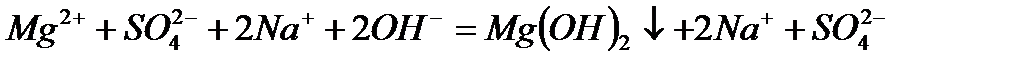
д) 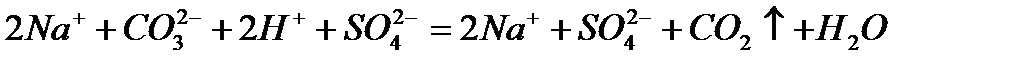
Исключая одинаковые ионы из правых и левых частей уравнений, получаем их краткие ионно-молекулярные формы:
а) 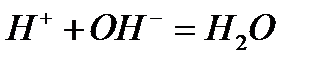
б) 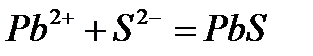
в) 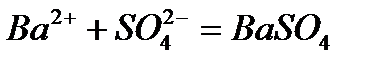
г) 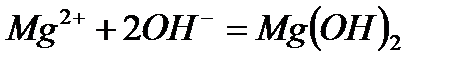
д) 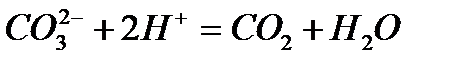
Пример 4. Составление ионно-молекулярных уравнений на основе их ионно–молекулярных форм.
Задача. Составьте молекулярные уравнения реакций, которым со-ответствуют ионно–молекулярные уравнения:
а) 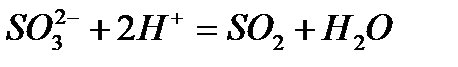
б) 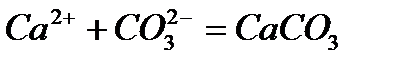
в) 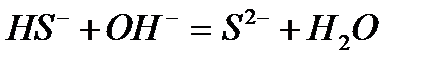
г) 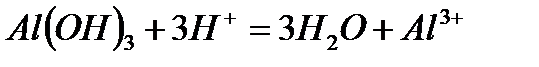
д) 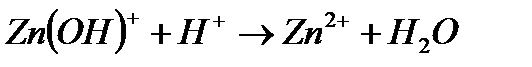
Решение. В левой части приведенных ионно–молекулярных уравне-ний указаны свободные ионы, которые образуются при диссоциации сильных электролитов. Поэтому при составлении молекулярных уравне-ний следует исходить из соответствующих водных растворов электроли-тов. Например:
|
|
|
а) 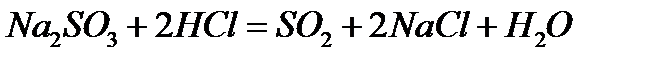
б) 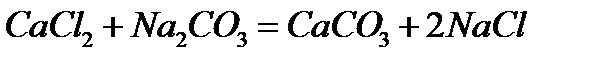
в) 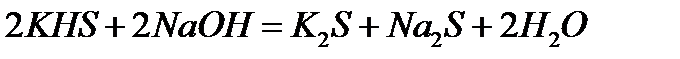
г) 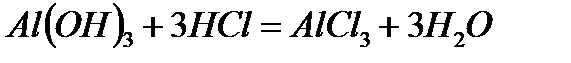
д) 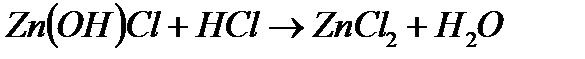
Пример 5. Определение растворимости электролита по величине произведения растворимости.
Задача. Произведение растворимости 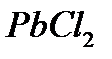 при
при 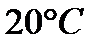 равно
равно 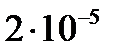 . Вычислите молярную концентрацию
. Вычислите молярную концентрацию 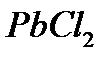 в насыщенном рас-творе при этой температуре.
в насыщенном рас-творе при этой температуре.
Решение. Между осадком 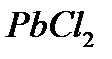 и его ионами в растворе существу-ет равновесие:
и его ионами в растворе существу-ет равновесие:
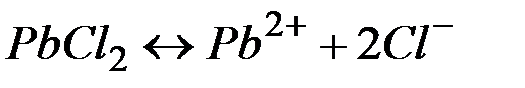
Произведение растворимости, характеризующее это равновесие
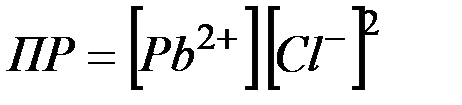
Растворимость 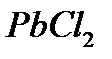 в соответствии с равновесием
в соответствии с равновесием
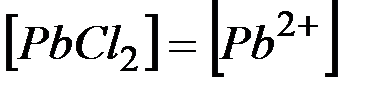
Обозначим 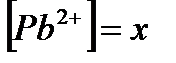 , тогда
, тогда 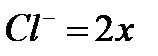 и
и  .
.
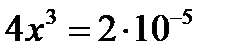 и
и 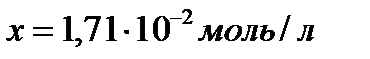 ,
,
т.е. растворимость 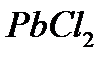 в воде при
в воде при 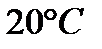 равна .
равна . 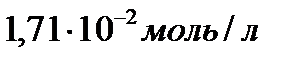
Пример 6. Вычисление произведения растворимости труднорастворимого электролита .
Задача. Растворимость фосфата серебра 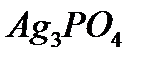 в воде при
в воде при 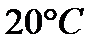 равна
равна 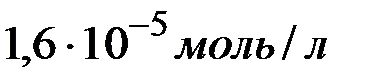 . Определить произведение растворимости этой соли.
. Определить произведение растворимости этой соли.
Решение. Диссоциация (растворение ) соли в воде характеризуется равновесием 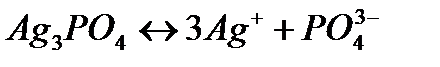
, откуда видно, что 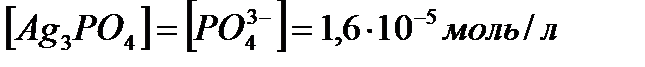 .
.
Тогда 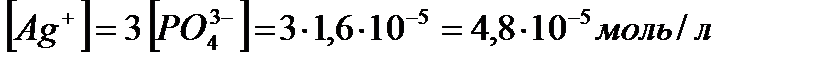 , а
, а 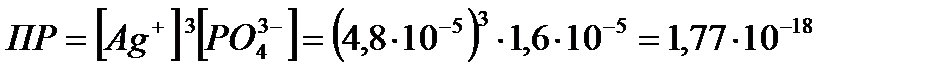 .
.
Пример 7 . Совместный гидролиз солей.
Задача. Обоснуйте, почему совместный гидролиз водного раствора солей 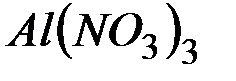 и
и 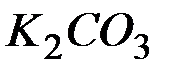 необратим и предложите продукты совместного гидролиза.
необратим и предложите продукты совместного гидролиза.
Решение. Каждая из указанных солей гидролизуется согласно уравнениям:
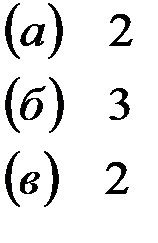
|
|
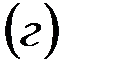
|
В результате этих процессов образуется пара кислота – основание 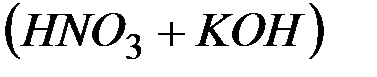 , которые вступают между собой в необратимую реакцию нейтрализации (в). Это обусловливает необратимость реакций (а) и (б). Суммирование левых и правых частей уравнений реакций (а), (б) и (в) приводит к стехиометрическому уравнению совместного гидролиза двух солей (г).
, которые вступают между собой в необратимую реакцию нейтрализации (в). Это обусловливает необратимость реакций (а) и (б). Суммирование левых и правых частей уравнений реакций (а), (б) и (в) приводит к стехиометрическому уравнению совместного гидролиза двух солей (г).
|
|
|
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции – это реакции, сопровождающиеся изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
В окислительно-восстановительных реакциях как минимум изменяется степень окисления двух элементов, входящих в состав окислителя и восстановителя. В более сложных случаях функцию окислителя или восстановителя могут выполнять два или более элементов.
Любая окислительно-восстановительная реакция – единый взаимосвязанный процесс. Окисление приводит к повышению степени окисления восстановителя, а восстановление - к ее понижению у окислителя. Соответственно окислитель, функцию которого выполняет атом, молекула или ион, принимает электроны в ходе окислительно-восстановительной реакции, а восстановитель – отдает их.
При составлении уравнений окислительно-восстановительных реакций в основном используют 2 метода: метод электронного баланса и метод электронно-ионного баланса.
|
|
|
Метод электронного баланса реализуется в несколько стадий:
1) установление формул исходных веществ и продуктов реакции;
2) определение степеней окисления элементов в реагентах и продуктах реакции;
3) определение числа электронов, отданных восстановителем и принятых окислителем;
4) определение коэффициентов перед формулами реагентов и продуктов реакции.
Метод электронно-ионного баланса более универсален по сравнению с методом электронного баланса и имеет неоспоримое преимущество при подборе коэффициентов во многих окислительно-восстановительных реакциях, особенно протекающих с участием органических соединений, в которых процедура определения степеней окисления является очень сложной. Составление уравнений этим методом осуществляется через ряд стадий:
1) определение окислителя и восстановителя, а также продуктов окисления и восстановления;
2) составление ионно-молекулярных уравнений полуреакций (окисления и восстановления) с учетом электронов;
3) определение на основе требования электронного баланса коэффициентов перед строками уравнений полуреакций;
4) суммирование левых и правых частей уравнений полуреакций и составление на этой основе уравнения окислительно-восстановительной реакции в ионно-молекулярной форме;
5) переход от ионно-молекулярной формы окислительно-восстановительной реакции к молекулярной.
При реализации этой последовательности необходимо придерживаться ряда правил. К ним относятся:
1) Участники реакции (реагенты и продукты) записываются в уравнениях полуреакций в той форме, в которой они присутствуют в растворе. Например, если в качестве окислителя используется сильный электролит дихромат калия, то в качестве окислителя в уравнении полуреакции записывают анион Cr 2 O 7 2- , реально присутствующий в растворе и осуществляющий функцию окисления. В то же время восстановитель, сульфид железа (II) FeS , записывается в молекулярной форме, поскольку он нерастворим и практически не диссоциирует на ионы. То же самое справедливо для газообразных участников реакции.
2) Если между реагентами и продуктами в уравнениях полуреакций происходит перераспределение кислорода, то для осуществления такого перераспределения используется:
– в кислой среде пара H + – H 2 O;
– в нейтральной среде пары H 2 O – H + , H 2 O – OH – ;
– в щелочной среде пара OH – – H 2 O.
При этом в случае нейтральной среды в левой части уравнений полуреакций всегда должна фигурировать вода.
3) В уравнениях полуреакций помимо баланса элементов должен соблюдаться зарядовый баланс, который устанавливается путем прибавления к левой части уравнения или вычитания из нее соответствующего количества электронов.
4) При переходе от ионно-молекулярной к молекулярной форме уравнения следует иметь в виду, что добавление в левую часть уравнения новых частиц (например, к дихромат-аниону Cr 2 O 7 2– добавляют стехиометрическое количество противоионовК+или Na +), эти частицы должны быть перенесены и в правую часть.
Принципиальная возможность осуществления окислительно-восстановительных реакций в стандартных условиях выявляется на основе разности электродных потенциалов окислителя и восстановителя
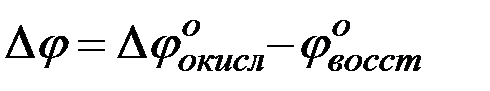 (1)
(1)
связанной с изменением энергии Гиббса соотношением
D G =– nF 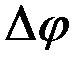 (2)
(2)
Из последнего выражения следует, что процесс принципиально осуществим при 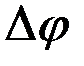 >0 ( D G < 0) и наоборот, процесс невозможен при
>0 ( D G < 0) и наоборот, процесс невозможен при 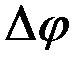 < 0 ( D G > 0).
< 0 ( D G > 0).
Дата добавления: 2021-12-10; просмотров: 55; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!