Работа газа при его расширении.
Изопроцессы — равновесные процессы, в которых один из основных параметров сохраняется.
ИЗОБАРНЫЙ ПРОЦЕСС (  )
)
Для изобарного процесса в идеальном газе справедлив закон Гей-Люссака:
при постоянном давлении объем данной массы газа прямо пропорционален его термодинамической температуре:
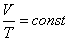 или
или  .
.
Работа газа при изобарном расширении:
 .
.
Изменение внутренней энергии:
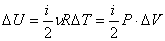
Количество полученного тепла в соответствии с первым началом термодинамики:
 .
.
Молярная теплоемкость при изобарном процессе:
 .
.
ИЗОХОРНЫЙ ПРОЦЕСС ( 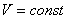 )
)
Изохорный процесс в идеальном газе описывается законом Шарля:
при постоянном объеме давление данной массы газа прямо пропорционально его термодинамической температуре:
 или
или  .
.
Работа газа при изохорном процессе равна нулю:  .
.
Все полученное тепло идет на изменение внутренней энергии в соответствии с первым началом термодинамики:
 .
.
Молярная теплоемкость при изохорном процессе:
 .
.
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС (  )
)
Изотермический процесс в идеальном газе подчиняется закону Бойля - Мариотта:
для данной массы газа при неизменной температуре произведение значений давления и объема есть величина постоянная:
 или
или  .
.
Работа газа при изотермическом расширении:
 .
.
Изменение внутренней энергии при изотермическом процессе равно нулю:
 .
.
Все полученное тепло идет на совершение работы в соответствии с первым началом термодинамики:
 .
.
Первое начало термодинамики и его применение к изопроцессам.
Q = ΔU + A
1. Изохорный
V = const => A = 0, Q = ΔU
Q = (i/2)*(m/M)*R* ΔT = (i/2) ΔpV
2.Изобарный
p = const => Q = ΔU+A
Q = (i/2)*(m/M)*R* ΔT + p ΔV = (i/2) pΔV + p ΔV
3.Изотермический
T = const => ΔU = 0, Q = A
Q = m/M*R* T*ln(V2/V1) = m/M*R* T*ln(p2/p1)
4.Адиабатный
Q = 0 => ΔU = -A = A’
Теплоемкость идеального газа.
Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус

Размерность теплоемкости: [C] = Дж/К.
Однако, теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости.
Удельная теплоёмкость (Суд) есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К.
Для газов удобно пользоваться молярной теплоемкостью Cμ- количество теплоты, необходимое для нагревания 1 моля газа на 1 градус

[Cμ] = Дж/(моль×К).
Из п. 1.2 известно, что молярная масса – масса одного моля

где А – атомная масса; mед - атомная единица массы; NА - число Авогадро; моль μ – количество вещества, в котором содержится число молекул, равное числу атомов в 12 г изотопа углерода 12С.
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании.
Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость при этом обозначается СV.
СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу (рис. 4.2).
Следовательно, проводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что  .
.
Итак, проводимое тепло и теплоёмкость зависят от того, каким путём осуществляется передача тепла. Значит, Q и С не являются функциями состояния.
Величины СР и СV оказываются связанными простыми соотношениями. Найдём их.
Пусть мы нагреваем один моль идеального газа при постоянном объёме(dA = 0). Тогда первое начало термодинамики запишем в виде:

т.е. бесконечно малое приращение количества теплоты  равно приращению внутренней энергии dU.
равно приращению внутренней энергии dU.
Теплоемкость при постоянном объёме будет равна:

В общем случае
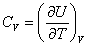
так как U может зависеть не только от температуры. Но в случае идеального газа справедлива формула (4.2.4).
Из (4.2.4) следует, что 

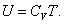
Внутренняя энергия идеального газа является только функцией температуры (и не зависит от V, Р и тому подобных), поэтому формула (4.2.5) справедлива для любого процесса.
Для произвольной идеальной массы газа:

При изобарическом процессе, кроме увеличения внутренней энергии, происходит совершение работы газом:


Из основного уравнения молекулярно-кинетической теории  . При изобарическом процессе Р = const. Следовательно, из (4.2.7) получим:
. При изобарическом процессе Р = const. Следовательно, из (4.2.7) получим: 
Это уравнение Майера для одного моля газа.
Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе.
Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж.
Полезно знать формулу Майера для удельных теплоёмкостей

или

Круговой процесс (цикл).
 Круговым процессом(или циклом)называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой (см.рис. a). Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1–2) и сжатия (2–1) газа. Работа расширения A1 (определяется площадью фигуры 1 a 2 V1 V2 2)положительна (dV>0)), работа сжатия A2 (определяется площадью фигуры 1 a 2 V1 V2 2) отрицательна (dV<0), Следовательно, работа A= A1+ A1,совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой. Еслиза циклсовершается положительная работаA>0 (цикл протекает по часовой стрелке), то он называется прямым(рис., а), если за цикл совершается отрицательная работа A<0 (цикл протекает против часовой стрелки), то он называется обратным(рис. b).
Круговым процессом(или циклом)называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой (см.рис. a). Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1–2) и сжатия (2–1) газа. Работа расширения A1 (определяется площадью фигуры 1 a 2 V1 V2 2)положительна (dV>0)), работа сжатия A2 (определяется площадью фигуры 1 a 2 V1 V2 2) отрицательна (dV<0), Следовательно, работа A= A1+ A1,совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой. Еслиза циклсовершается положительная работаA>0 (цикл протекает по часовой стрелке), то он называется прямым(рис., а), если за цикл совершается отрицательная работа A<0 (цикл протекает против часовой стрелки), то он называется обратным(рис. b).
Прямой цикл используется в тепловых двигателях – периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах -периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю (D U = 0). В общем случае при протекании кругового процесса система может теплоту как получать Q1, так и отдавать Q2, поэтому теплота, полученная системой Q равна Q = Q1– Q2
Поэтому из первого начала термодинамики для кругового процесса (когда D U = 0) получаем, что работа за цикл равна
А = Q1– Q2
т. е. работа, совершаемая за цикл, равна разности количества полученной извне теплоты Q1 и отданной системой Q2. Поэтому коэффициент полезного действия длякругового процесса(к. п. д.)

Термодинамический процесс называется обратимым,если он может происходить как в прямом, так и в обратном направлении; причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Любой равновесный процесс является обратимым. Обратимость равновесного процесса, происходящего в системе, следует из того, что ее любое промежуточное состояние есть состояние термодинамического равновесия; для него «безразлично», идет процесс в прямом или обратном направлении. Реальные процессы сопровождаются диссипацией энергии (из-за трения, теплопроводности и т.д.), которая нами не обсуждается. Обратимые процессы – это идеализация реальных процессов. Их рассмотрение важно по двум причинам:
1) многие процессы в природе и технике практически обратимы;
2) обратимые процессы являются наиболее экономичными; имеют максимальный коэффициент полезного действия, что позволяет указать пути повышения к. п. д. реальных тепловых двигателей.
Цикл Карно.
Описание цикла Карно

Цикл Карно в координатах P и V
Цикл Карно в координатах T и S
Пусть тепловая машина состоит из нагревателя с температурой  , холодильника с температурой
, холодильника с температурой  и рабочего тела.
и рабочего тела.
Цикл Карно состоит из четырёх стадий:
Изотермическое расширение (на рисунке — процесс A→Б). В начале процесса рабочее тело имеет температуру  , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты
, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты  . При этом объём рабочего тела увеличивается.
. При этом объём рабочего тела увеличивается.
Адиабатическое (изоэнтропическое) расширение (на рисунке — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Изотермическое сжатие (на рисунке — процесс В→Г). Рабочее тело, имеющее к тому времени температуру  , приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты
, приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты  .
.
Адиабатическое (изоэнтропическое) сжатие (на рисунке — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия:
 при
при  .
.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
КПД тепловой машины Карно
Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
 .
.
Аналогично, при изотермическом сжатии рабочее тело отдало холодильнику
 .
.
Отсюда коэффициент полезного действия тепловой машины Карно равен
 .
.
Из последнего выражения видно, что КПД тепловой машины Карно зависит только от температур нагревателя и холодильника. Кроме того, из него следует, что КПД может составлять 100 % только в том случае, если температура холодильника равна абсолютному нулю. Это невозможно, но не из-за недостижимости абсолютного нуля (этот вопрос решается только третьим началом термодинамики, учитывать которое здесь нет необходимости), а из-за того, что такой цикл или нельзя замкнуть, или он вырождается в совокупность двух совпадающих адиабат и изотерм.
Поэтому максимальный КПД любой тепловой машины будет меньше или равен КПД тепловой машины Карно, работающей при тех же температурах нагревателя и холодильника. Например, КПД идеального цикла Стирлинга равен КПД цикла Карно.
Энтропия.
Энтропия -- это функция состояния, то есть любому состоянию можно сопоставить вполне определенное (с точность до константы -- эта неопределенность убирается по договоренности, что при абсолютном нуле энтропия тоже равна нулю) значение энтропии.
Для обратимых (равновесных) процессов выполняется следующее математическое равенство (следствие так называемого равенства Клаузиуса)
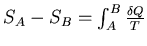 ,
,
где  -- подведенная теплота,
-- подведенная теплота, 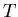 -- температура,
-- температура, 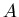 и
и  -- состояния,
-- состояния,  и
и 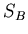 -- энтропия, соответствующая этим состояниям (здесь рассматривается процесс перехода из состояния
-- энтропия, соответствующая этим состояниям (здесь рассматривается процесс перехода из состояния 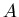 в состояние
в состояние  ).
).
Для необратимых процессов выполняется неравенство, вытекающее из так называемого неравенства Клаузиуса
 ,
,
где  -- подведенная теплота,
-- подведенная теплота, 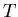 -- температура,
-- температура, 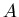 и
и  -- состояния,
-- состояния,  и
и 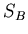 -- энтропия, соответствующая этим состояниям.
-- энтропия, соответствующая этим состояниям.
Поэтому энтропия адиабатически изолированной (нет подвода или отвода тепла) системы при необратимых процессах может только возрастать.
Используя понятие энтропии Клаузиус (1876) дал наиболее общую формулировку 2-го начала термодинамики: при реальных (необратимых) адиабатических процессах энтропия возрастает, достигая максимального значения в состоянии равновесия (2-ое начало термодинамики не является абсолютным, оно нарушается при флуктуациях).
Подводим итог: Что бы мы не делали -- энтропия увеличивается, следовательно любыми своими действиями мы увеличиваем хаос, и, следовательно, приближаем "конец света". Вероятно, можно точно подсчитать, когда он, то есть "конец света", наступит, но я думаю, что ближайшие несколько миллиардов лет можно об этом не беспокоиться.
Второе начало термодинамики.
Первое начало термодинамики установило эквивалентность при преобразованиях внутренней энергии, теплоты и работы. Это позволяет определить, возможен ли с энергетической точки зрения тот или иной процесс. Но первое начало термодинамики ничего не говорит о возможности протекания таких процессов в природе (в частности, самопроизвольных). Так, например, первое начало термодинамики не запрещает самопроизвольный переход теплоты от тела менее нагретого к более нагретому (от холодного к горячему). Но, как известно, в природе такие процессы не наблюдаются. Один из вариантов формулировки второго начала термодинамики (по Клаузиусу) как раз и запрещает такой процесс: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому. Также было установлено и неравноправие взаимных переходов теплоты и работы при циклических процессах: полный переход работы в теплоту возможен, а вот обратный – лишь частично.
Второе начало термодинамики устанавливает:
1) направление самопроизвольных процессов в природе;
2) условие осуществление процессов превращения теплоты в работу.
1. Система отсчета. Скорость.
2. Ускорение и его составляющие.
3. Угловая скорость и угловое ускорение.
4. Законы Ньютона.
5. Неинерциальные системы отсчета. Силы инерции.
6. Закон сохранения импульса.
7. Работа силы.
8. Консервативные силы. Потенциальная энергия.
9. Закон сохранения полной механической энергии.
10. Удар абсолютно упругих тел.
11. Удар абсолютно неупругих тел. Диссипация энергии.
12. Момент инерции.
13. Теорема Штейнера.
14. Кинетическая энергия вращающеюся тела.
15. Основной закон динамики вращательного движения.
16. Закон сохранения момента импульса.
17. Давление в жидкости и газе.
18. Устанавливается движение жидкости. Уравнение неразрывности. Выталкивающая сила Архимеда
19. Уравнение Бернулли. Динамическое давление.
20. Вязкость. Движение тел в жидкостях и газах.
21. Постулаты специальной теории относительности.
22. Преобразования Лоренца.
23. Интервал между событиями и его инвариантность.
24. Релятивистское выражение для импульса.
25. Основной закон релятивистской динамики.
26. Закон взаимосвязи массы и энергии.
27. Уравнение состояния идеального газа.
28. Основное уравнение молекулярно-кинетической теории идеальных газов.
29. Закон Максвелла о распределении по скоростям теплового движения.
30. Барометрическая формула. Распределение Больцмана.
31. Среднее число столкновений и средняя длина свободного пробега молекул.
32. Явления переноса в газах.
33. Реальные газы. Уравнение Ван-дер-Ваальса.
34. Изотермы реальных газов и их сравнения с теоретическими.
35. Внутренняя энергия системы.
36. Работа газа при его расширении.
37. Первое начало термодинамики и его применение к изопроцессам.
38. Теплоемкость идеального газа.
39. Круговой процесс (цикл).
40. Цикл Карно.
41. Энтропия.
42. Второе начало термодинамики.
Дата добавления: 2018-02-18; просмотров: 9383; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
