Кондуктометрическое титрование. Определения электропроводности наз-сякондуктометрическими определениями
Определения электропроводности наз-сякондуктометрическими определениями. Кондуктометрия исп-ся для определения рядя физико-химических характеристик электролитов и растворов: степени и константы диссоциации слабых электролитов, константы гидролиза солей, растворимости труднорастворимых соединений. Большое практическое значение имеет кондуктометрическое титрование, т.е определение конц-ии электролита в р-ре путем измерения электропроводности при титровании. Этот способ особо ценен в случае мутных или сильно окрашенных растворов, которые титровать с применением обычных индикаторов невозможно.
Суть данного метода заключается в том, что ионы, содержащиеся в прибавляемом р-ре соединяются с теми или другими ионами из находящихся в титруемом р-ре, образуя молекулы слабодиссоциирующего соединения (н-р, Н++ ОН-→Н2О) или малорастворимое вещ-во (н-р, Аg++CI-→AgCI). В получаемом р-ре взамен удаленных ионов будут содержаться другие ионы в эквивалентном кол-ве. Т.к. подвижность ионов различна такая замена приведет к изменению эл/проводности р-ра.
Пр-р: при титровании р-ра гидроокиси натрия взамен ионов ОН- в р-р будут поступать ионы CI-, а т.к. ионы CI- обладают меньшей подвижностью, это вызовет ум-е эл/проводности. Н-р, молярная электропроводность сильно разбавленного р-ра гидроокиси натрия равна сумме подвижностей ионов Na+ и ОН- и составляет при 180С:

При полной нейтрализации едкого натрия соляной кислотой в р-ре остаются только ионы Na+ и CI- и молярная эл/проводность р-ра равна:
|
|
|
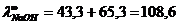 .
.
След-но при постепенном прибавлении к р-ру HCI эл/проводность р-ра изменяется 217,3 до 108,6. При дальнейшем прибавлении кислоты кол-во ионов в р-ре ув-ся сверх эквивалентного, причем появляются высокоподвижные ионы Н+.
На кривой кондуктометрического титрования сильной кислоты сильным основанием получаем две пересекающиеся прямые АВ и ВС, точка пересечения которых отвечает точке эквивалентности.
При титровании сильного основания слабой кислотой эл/проводность после достижения минимума возрастает очень слабо, т.к. при избытке малодиссоциированной кислоты в р-ре появляется небольшое кол-во свободных ионов, которые не могут сильно увеличивать эл/проводность, поэтому ветвь ВС/ располагается в этом случае почти горизонтально. Подобные же соотношения имеют место при титровании сильной кислоты слабым основанием.
Лекция 3 Электродные процессы. Возникновение потенциала на границе раздела двух фаз. Строение двойного электрического слоя. Электродные потенциалы. ЭДС электрохимической системы. Уравнение Нернста
Электродные процессы
|
|
|
К электродным процессам относятся две группы процессов, тесно связанных между собой:
I группа – процессы возникновения разности потенциалов и, след-но, электрического тока в результате протекания химической реакции (н-р, в гальванических элементах, в этих процессах энергия химических реакций превращается в электрическую).
II группа – обратные или химические реакции, протекающие при пропускании электрического тока – это процессы электролиза (в них электрическая энергия превращается в химическую).
Рассмотрим возникновение электродных потенциалов для процессов I группы.
При погружении любого металла в раствор электролита, на границе металл – раствор возникает разность электрических потенциалов - электродный потенциал. Возникновение электродного потенциала на границе металл – раствор обусловлено протеканием на ней электрохимических процессов – электродных процессов.
Н-р, возьмем пластинку из цинка и погрузим ее в раствор соли цинка, то цинк частично растворяется с поверхности, выделяя положительные ионы в раствор. Электроны, связанные с этими ионами, остаются на поверхности пластинки, заряжая ее отрицательно. Положительно заряженные ионы цинка, перешедшие в раствор, притягиваются отрицательно заряженной поверхностью пластинки и располагаются около нее. В результате образуются два слоя с противоположными зарядами - двойной слой. Цинковая пластинка не растворяется бесконечно и при определенной конц-ии ионов цинка устанавливается равновесие, при котором скорость перехода ионов цинка с пластинки в раствор равна скорости обратного перехода этих ионов из раствора на пластинку. Аналогично цинку ведут себя все химически активные металлы (стоящие левее водорода в ряду активности): Fe, AI, Co, Cd и т.д.
|
|
|
При любых практически возможных конц-ях солей эти металлы растворяются с поверхности и имеют отрицательное значение электродного потенциала.
Если взять пластинку из малоактивного металла, н-р, медь и поместить ее в соль меди, то происходит обратный процесс, который состоит в том, что ионы меди переходят из р-ра на пластинку, заряжая ее положительно. В результате образуется двойной электрический слой, а р-р за счет избытка анионов SO4- заряжается отрицательно. В результате образуется двойной электрический слой. Аналогично ведут себя все неактивные благородные металлы: Pt, Pd, Ag, Au.
При любых практически возможных концентрациях солей эти малоактивные металлы осаждают катионы из раствора и имеют положительное значение электродного потенциала.
|
|
|
Величина электродного потенциала зависит от свойств металла и р-ра, особенно от конц-ии ионов металла в р-ре, температуры.
Электродные (потенциалопределяющие) процессы представляют собой окислительно-восстановительные р-ции, которые можно записать в следующем виде:
 .
.
Если в р-ции уч-ет только одно вещ-во в окисленной (Ox) и восстановленной (Red) формах, то р-ция записывается в следующем виде:
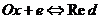 .
.
Различают обратимые и необратимые электроды. При изменении направления электрического тока на обратимых электродах возникают р-ции, противоположные по направлению, на необратимых – не обратные друг другу. Пр-р обратимого электрода: медь в р-ре Cu2+. При прохождении тока в противоположных направлениях идут р-ции Cu2++2e→Cu и Cu→Cu2++2е. Пр-р необратимого электрода: медь в р-ре кислоты. При изменении направлении тока идут р-ции 2Н++2е→Н2 и Cu→Cu2++2е.
Из обратимых электродов составляют электрохимические цепи (пары, гальванические элементы). Примером обратимой цепи служит элемент Даниэля-Якоби.
Гальванический элемент – это устройство, состоящее из двух электродов, в котором энергия химической р-ции преобразуется в электрическую. Гальванические элементы служат источниками постоянного тока.
В основе работы любого гальванического элемента лежит ОВР, проводимая так, что на одном из электродов (отрицательном) происходит окисление, на другом - положительном (восстановление).
Рассмотрим элемент, называемый элементом Даниэля – Якоби. Он состоит из цинковой и медной пластинок, погруженных соответственно в р-ры ZnSO4 и CuSO4. Р-ра отделены друг от друга пористой перегородкой, на позволяющей им перемешиваться. Цинк в большей степени способен выделять катионы в р-р, чем медь, поэтому цинковый электрод заряжается отрицательно, а медный – положительно. Если пластинки соединить проволокой, то по ней электроны с цинковой пластинки перейдут на медную. Это нарушит равновесие в двойных электрических слоях и возникнет самопроизвольный процесс, при котором цинковая пластинка растворяется, освободившиеся электроны по проводнику переходят на медную пластинку и восстанавливают катионы меди, и на медной пластинке из раствора осаждается медь. Переход электронов даст электрический ток, и, помещая на пути электронов электроизмерительные приборы, этот ток можно измерить.
В этом элементе электрическая энергия получается в результате химической р-ции
Zn + CuSO4=Cu+ZnSO4,
или в ионной форме
Zn + Cu2+=Zn2++ Cu.
Рассматриваемая р-ция складывается из окислительного процесса, протекающего на цинковой пластинке
Zn→Zn2++2e
и восстановительного процесса на медной пластинке
Cu2++2e→Cu.
При схематической записи электрохимических систем необходимо соблюдать следующие правила. Для электродов (полуэлементов): вещ-ва, находящиеся в р-ре указываются слева от вертикальной черты, а справа указываются вещ-ва, образующие другую фазу, или электродный материал. Если одна фаза содержит несколько вещ-в, то их символы разделяются запятыми.
Cu2+|Cu; Н+|Н2, Pt; Co3+, Co2+|Pt.
Ур-е электродной р-ции записывается так, чтобы слева располагались вещ-ва в окисленной форме и электроны, а справа вещ-ва в восстановленной форме:
Cu2++2e→Cu;
2Н++2е→Н2;
Co3++е→Co2+.
Для электрохимических цепей: слева располагается электрод, имеющий более отрицательный потенциал; р-ры обоих электродов отделяются вертикальной пунктирной линией, если они контактируют друг с другом и двумя сплошными линиями, если между растворами находится солевой мостик.
Pt, H2|HCI CuCI2|Cu
Zn|Zn2+||Ag+|Ag
Электрической характеристикой электрода яв-ся потенциал, а электрохимической цепи – электродвижущая сила (ЭДС), равная алгебраической сумме разностей потенциалов, возникающих на границах раздела фаз, входящих в состав цепи.
Zn|ZnSO4||CuSO4|Cu
с1 с2
П- ПД П+
Е= П-+ПД +П+
Диффузионный потенциал возникает на границе раздела двух растворов вследствие различной подвижности ионов.
Скачки потенциала между фазами не поддаются экспериментальному определению. Т.к. ЭДС электрохимической цепи может быть легко измерена, то принято электродный потенциал считать равным ЭДС цепи, составленной из водородного (слева) и данного электрода (справа). Водородный электрод взят в стандартном состоянии (ан+=1); парциальное давление газа равно нормальному атмосферному; его потенциал при любой температуре принят равным нулю. Значения электродных потенциалов выражаются в условной водородной шкале. При измерении ЭДС диффузионный потенциал удобно устранить с помощью солевого мостика, который содержит концентрированный раствор электролита, молярные электрические проводимости которого приблизительно одинаковы (КCI, KNO3). Солевой мостик, в котором содержится , н-р КCI, располагают между растворами электрохимической цепи, и вместо одной жидкостной границы в системе возникают две. Т.к. конц-ия ионов в р-ре КCI выше, чем в соединяемых им р-рах, то практически только ионы К+ и CI- диффундируют через жидкостные границы, на которых возникают малые и обратные по знаку диффузионные потенциалы, суммой которых можно пренебречь.
Обратимые электроды и электрохимические цепи могут быть рассмотрены в термодинамически обратимом (равновесном) состоянии. Условием, определяющем термодинамическую обратимость электрохимических систем яв-ся отсутствие электрического тока или протекание через них бесконечно малого тока. Если через систему проходит измеримый ток, то она перестает быть термодинамически обратимой и описывается законами электрохимической кинетики.
Уравнение Нернста
В основе работы гальванического элемента Даниэля – Якоби лежит следующая окислительно - восстановительная р-ция:
Zn + Cu2+=Zn2++ Cu.
Работа, совершаемая гальваническим элементом, равна произведению ЭДС элемента на количество электричества, которое элемент вырабатывает:
W/= ЕnF, (1)
где Е – ЭДС элемента; n – число электронов, участвующих в одном электродном процессе (заряд иона); F – число Фарадея.
С другой стороны по ур-ю изотермы химической р-ции
W/=RTlnKP-RTlnПР (2)
Из (1) определяем Е
 . (3)
. (3)
Ур-е (2) подставим в (3)
 ,
,
где  при равновесии
при равновесии
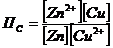 неравновесное отношение концентраций
неравновесное отношение концентраций
 . (4)
. (4)
Подставим КР и ПР в ур-е (4)
 .
.
Учитывая, что конц-ии твердых цинка и меди постоянны и равны 1
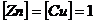 , получим
, получим
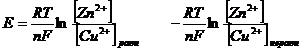 .
.
ЭДС для элемента Даниэля Якоби равна разности потенциалов медного и цинкового электродов:
 .
.
 . (5)
. (5)
Слагаемые правой и левой частей ур-я (5) должны быть попарно равны друг другу:
 ; (6)
; (6)
 . (7)
. (7)
Если конц-ии ионов Cu2+ и Zn2+ в исходной неравновесной системе равны 1г-ион/л
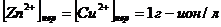 ,
,
т.к. ln1=0, то ур-я (6) и (7) преоразуются
 ; (8)
; (8)
 . (9)
. (9)
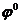 - стандартный или нормальный электродный потенциал.
- стандартный или нормальный электродный потенциал.
Стандартным электродным потенциалом наз-ся потенциал, который возникает при конц-ии ионов металла в р-ре 1г-ион/л.
Подставив (8) и (9) в (6), (7), получим
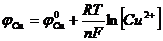 ;
;
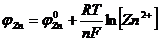 .
.
В общем случае

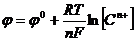 . (10)
. (10)
Ур-е (10) – ур-е Нернста, выражающее зависимость электродного потенциала от конц-ии ионов металла в р-ре. Если R=8,314 Дж/моль∙К; F=96500;Т=298К, то  .
.
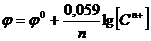 (11)
(11)
Для р-ров электролитов с высокой конц-ей следует конц-ии в ур-ях (10) и (11) заменить на активности ионов в р-рах
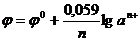 .
.
Активность и моляльность связаны ур-ем
 ,
,
где а – активность ионов металла в р-ре; γ – коэффициент активности; сm – моляльность р-ра (количественный состав р-ра может быть выражен и другими способами, но для р-ров электролитов их состав обычно выражается в моляльности).
Дата добавления: 2018-02-18; просмотров: 475; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
